薬物動態の特性
脳内移行性(マウスモデルの結果)
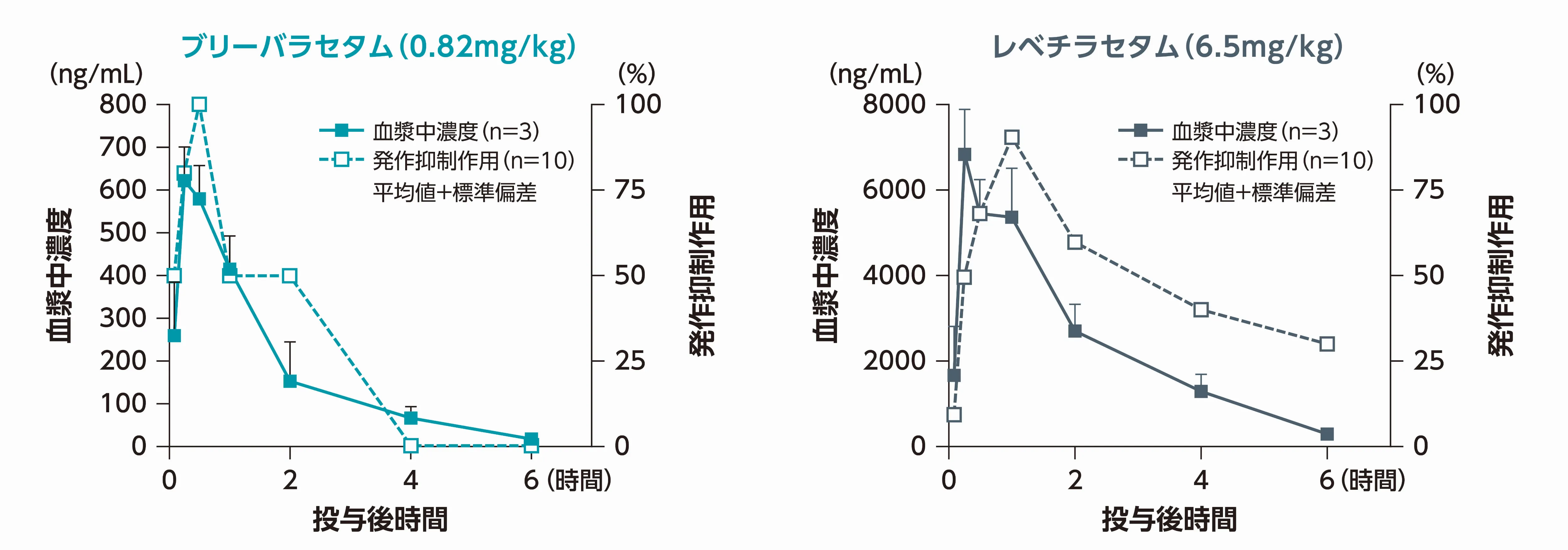
ブリーバラセタムは投与後30分で最大の発作抑制作用を示し、かつ最高血漿中濃度に到達しました。
一方、レベチラセタムは、最高血漿中濃度到達時間に対して約1時間遅れて最大の発作抑制作用を示しました。
- 方法:
-
聴原性発作マウスにブリーバラセタム0.82mg/kg又はレベチラセタム6.5mg/kg(薬理学的モデルにおいて同等の作用が示された用量)を単回経口投与し、5、15、30、60、120、240、360分後に音響刺激を与え、投与後各時点(各n=10)での間代発作抑制マウスの割合から発作抑制作用を検討した。また、投与後の異なる時点(各n=3)で脳及び血液試料を採取し、薬物動態を評価した。
Nicolas JM, et al. Epilepsia. 2016; 57: 201-209より改変(COI:本試験はUCB Pharmaの支援により実施した。)
Brivaracetam, a selective high-affinity synaptic vesicle protein 2A (SV2A) ligand with preclinical evidence of high brain permeability and fast onset of action, Nicolas JM, et al.
Copyright ©2015 The Authors. Epilepsia published by Wiley Periodicals, Inc. on behalf of International League Against Epilepsy .
Reproduced with permission of John Wiley & Sons Inc.
脳内移行性(健康成人の結果)
レベチラセタムは約20分※に対し、ブリーバラセタムは約2~10分※で脳内へ移行しました。
- ※
- 脳内移行半減時間(補正値)
| ブリーバラセタム100mg (n=4) |
ブリーバラセタム200mg (n=2) |
レベチラセタム1500mg (n=6) |
|---|---|---|
| 10.0 ± 6.3分 | 1.7分, 2.1分 | 20.5 ± 5.7分 |
平均値±標準偏差
- 方法:
- 外国人健康成人を対象に、コホート1(n=4)[ベースライン時及び静脈内にブリーバラセタム(100mg)又はレベチラセタム(1500mg)投与後の置換中にPETで検査]及びコホート2(n=5)[置換中及び投与(ブリーバラセタム50~200mg又はレベチラセタム1500mg)後4時間に検査]において、11C-UCB-Jシグナルの減少率を定量化し、ブリーバラセタム又はレベチラセタムの脳内移行及び結合率の尺度として使用した。薬剤投与から最大トレーサー変位50%到達までの時間(トレーサー置換半減時間)は、各脳領域と代謝産物の濃度が補正された血漿の放射能濃度比の経時的変化を使用して推定された。薬剤の脳内移行半減時間(補正値)は、トレーサー置換半減時間からトレーサークリアランス半減時間を減算することによって推定した。
Finnema SJ, et al. Epilepsia. 2019; 60: 958-967より作表(COI:著者にはUCB Pharmaの社員又は元社員が含まれた。本試験はUCB Pharmaの支援により実施した。)
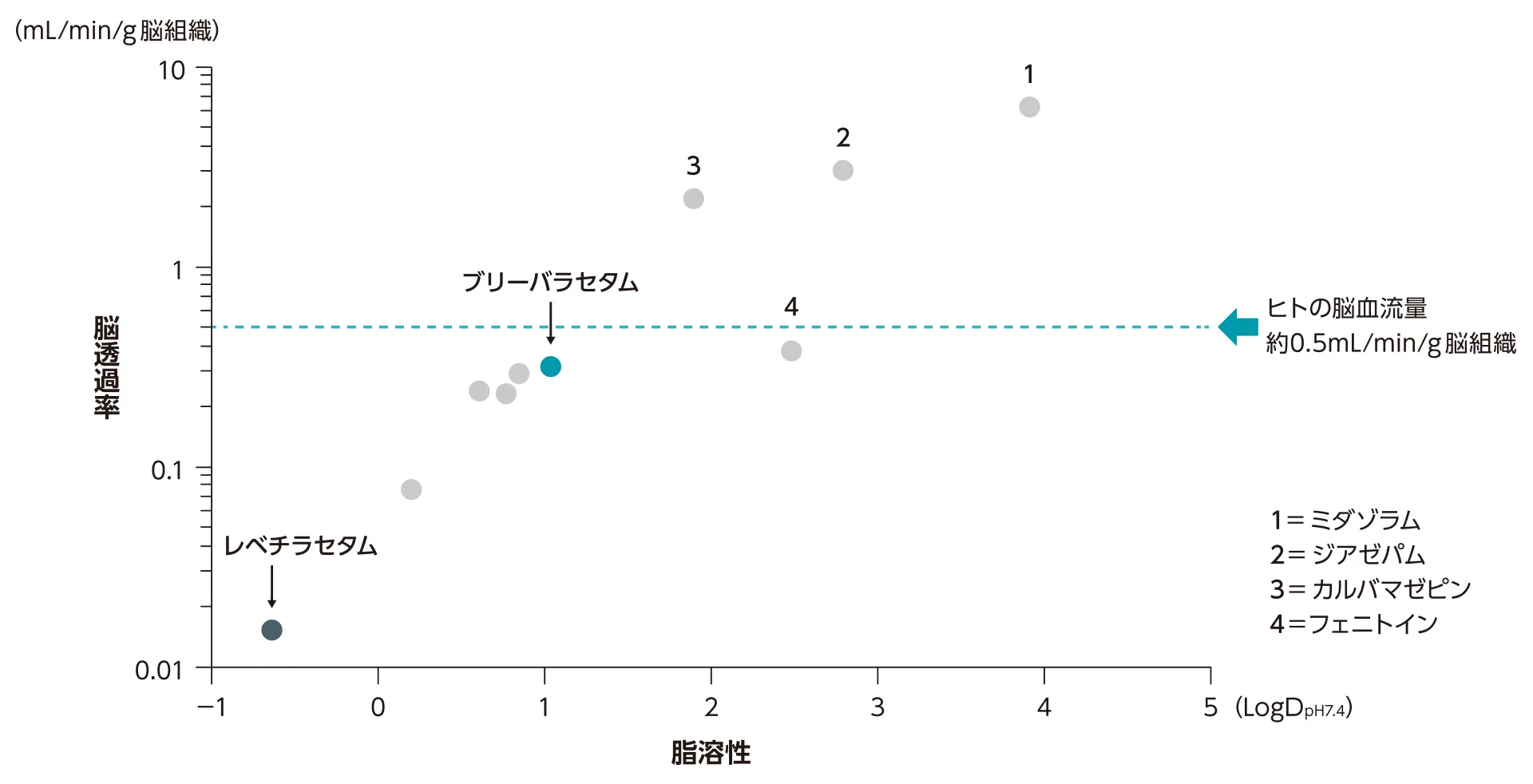
脳透過率と脂溶性(生理学的薬物動態モデリング)
脳透過率と脂溶性には正の相関が認められており、ブリーバラセタムは、レベチラセタムに比べ脂溶性が高く脳透過率が高いことが報告されています。
- 方法:
-
聴原性マウスのPK/PDデータと、血液脳関門(BBB)を介した薬剤の取り込みと脳への動態を説明する生理学的薬物動態モデリングを構築し、血漿及び脳濃度の測定後、BBB透過率(PS)コンポーネント(in vivoBBB透過率表面積)を組み込んだモデルを適用した。次に、モデルから得られたBBB透過率を用いて、ヒトの脳内のブリーバラセタム及びレベチラセタム濃度を予測した。脳濃度は、ブリーバラセタム100mg、又はレベチラセタム1500mgの単回静脈内投与後の健康成人被験者の血漿濃度値からBBB透過率を計算し、ヒトの脳動態をシミュレートした。また、同じ生理学的薬物動態モデリングを他のSV2Aリガンドに適用した。
Nicolas JM, et al. Epilepsia. 2016; 57: 201-209より改変
(COI:本研究はUCB Pharmaの支援により行われた。著者にはUCB Pharmaの社員、UCB Pharmaから研究支援を受けた者が含まれた。)
Copyright © 2015 The Authors. Epilepsia published by Wiley Periodicals, Inc. on behalf of International League Against Epilepsy.
Reproduced with permission of John Wiley & Sons Inc.
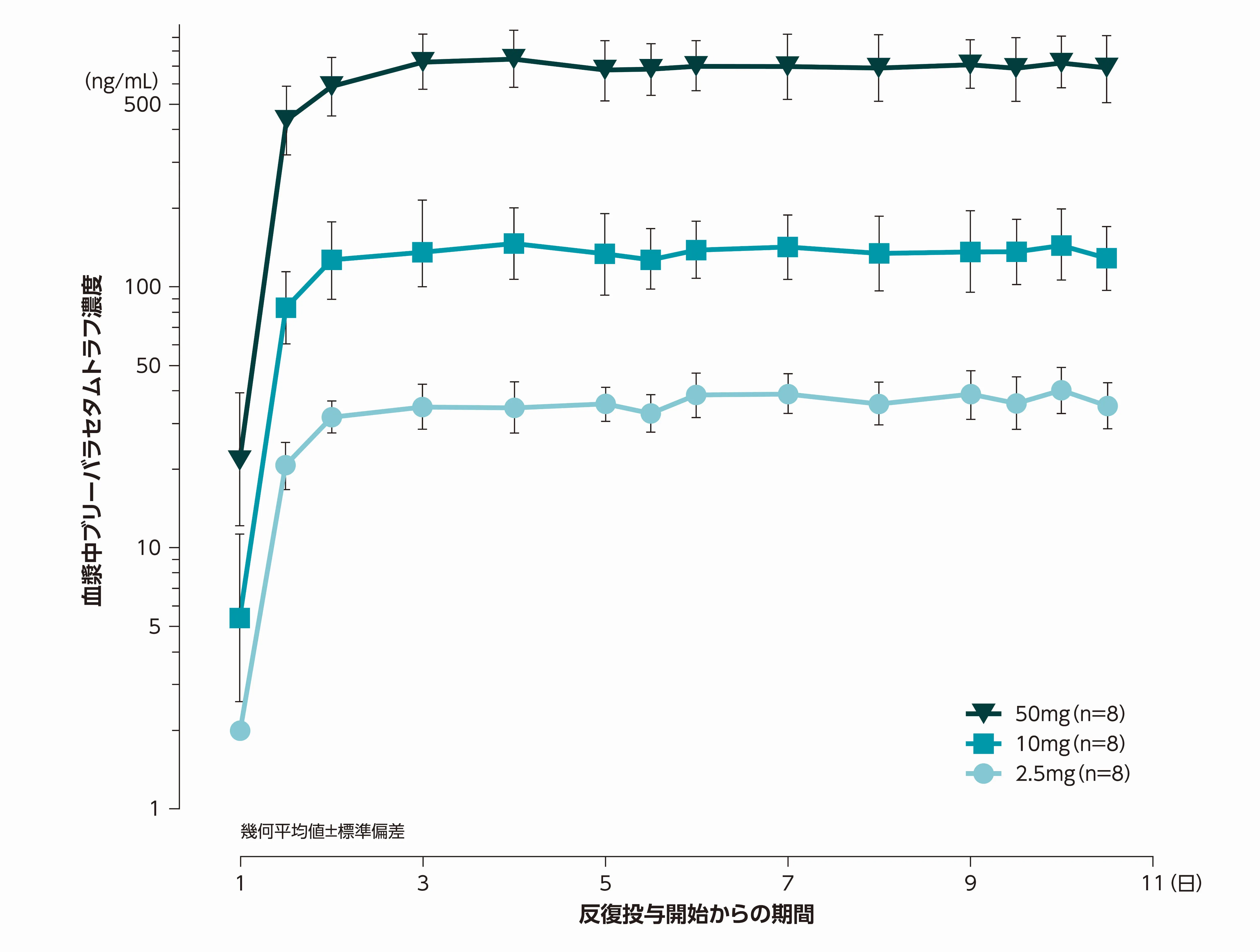
血中濃度推移(反復投与時)
血漿中トラフ濃度は、用量にかかわらず、投与後30分でCmaxを示し、投与開始後2日目には定常状態に達すると推測されました。
- 方法:
-
日本人健康成人男性被験者にブリーバラセタムを1回2.5mg、10mg又は50mg(各投与量8例)を単回投与後、1日2回10日間反復投与した。
社内資料:日本人健康被験者における単回経口投与(パートA)及び反復経口投与(パートB)時の薬物動態(N01209試験)、承認時評価資料
Stockis A, et al. Drug Metab Pharmacokinet. 2014; 29: 394-399
(COI:本研究はUCB Pharmaの支援により行われた。著者、統計学的解析及び執筆協力者にはUCB Pharmaの社員が含まれた。)
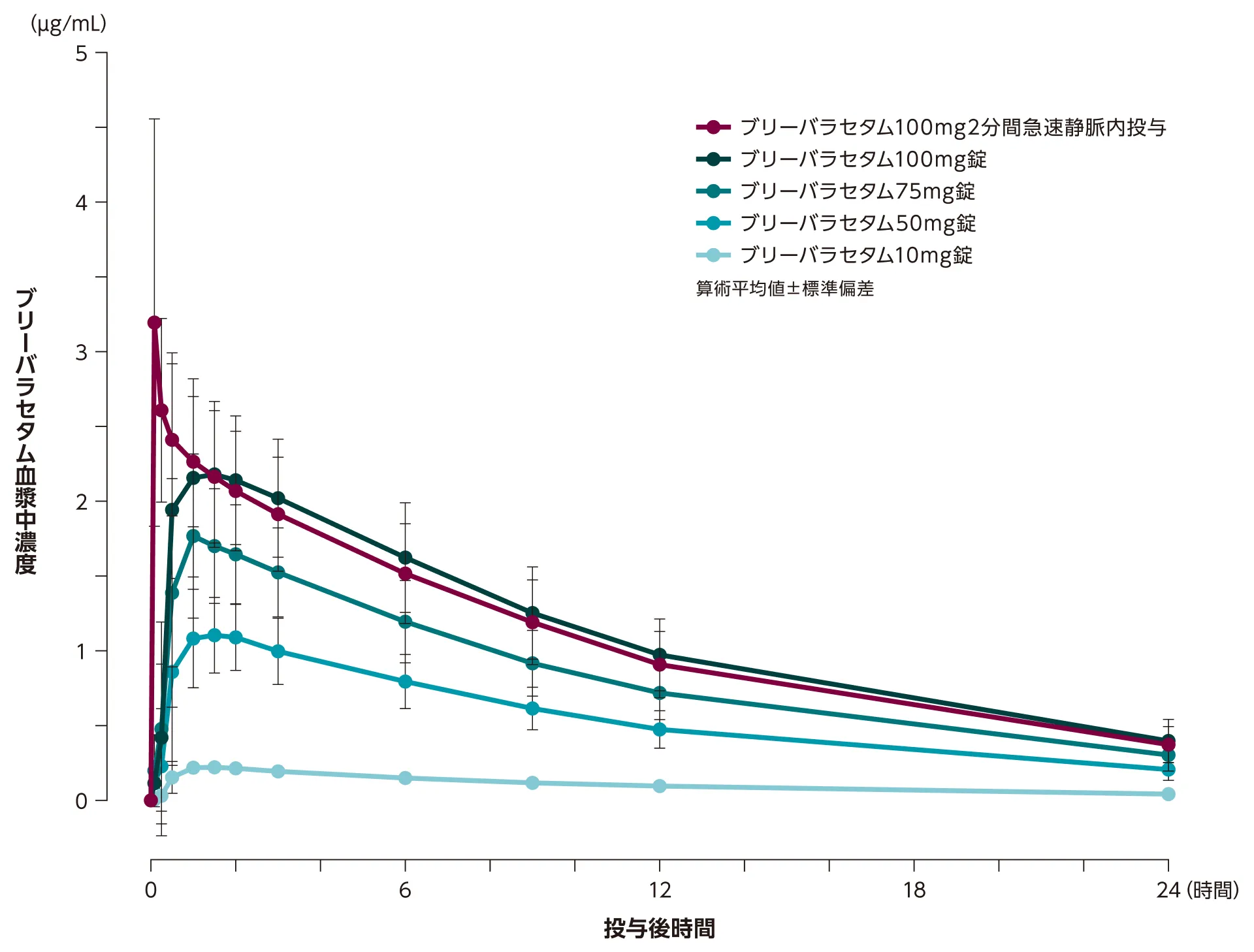
血中濃度推移(単回投与時)
2分間急速静脈内投与したときの最高血漿中濃度到達時間(Tmax、中央値)は、4.8分でした。
- 方法:
-
外国人健康成人24例にブリーバラセタム錠10mg、錠50mg、錠75mg、錠100mgを単回経口投与又は静注100mgを10mg/mL注として2分間で静脈内に単回投与した。各治療期間中、投与前及び投与後0.08、0.25、0.5、1、1.5、2、3、6、9、12、24、36、48時間で血液サンプル(4mL)を採取した。
Stockis A, et al. Epilepsia. 2016; 57: 1288-1293
(COI:本研究はUCB Pharmaの支援により行われた。著者、統計学的解析及び執筆協力者にはUCB Pharmaの社員が含まれた。)
Copyright © 2016 The Authors. Epilepsia published by Wiley Periodicals, Inc. on behalf of International League Against Epilepsy.
Reproduced with permission of John Wiley & Sons Inc.
ブリィビアクト錠25mg・50mg
- 6.
-
用法及び用量
通常、成人にはブリーバラセタムとして1日50mgを1日2回に分けて経口投与する。なお、症状により1日200mgを超えない範囲で適宜増減できる。
- 18.
-
薬効薬理(抜粋)
- 18.1
-
作用機序
ブリーバラセタムは、脳内のシナプス小胞蛋白質2A(SV2A)に高い親和性を示し、選択的に結合する。ブリーバラセタムとSV2Aの結合が発作抑制作用に寄与しているものと考えられている。
ブリィビアクト静注25mg
- 6.
-
用法及び用量
ブリーバラセタムの経口投与から本剤に切り替える場合:通常、ブリーバラセタム経口投与と同じ1日用量及び投与回数にて、1回量を2分から15分かけて静脈内投与する。
ブリーバラセタムの経口投与に先立ち本剤を投与する場合:通常、成人にはブリーバラセタムとして1日50mgを1日2回に分け、1回量を2分から15分かけて静脈内投与する。
いずれの場合においても、症状により適宜増減できるが、1日最高投与量は200mgとする。
