ブリィビアクトとは
ブリィビアクトの特徴
-
神経終末のシナプス小胞タンパク質2A(SV2A)に高い親和性※1と選択性をもった結合により、発作抑制作用を発揮します。カルシウムチャネル及びAMPA受容体にそれぞれ1000μM及び100μMまで作用しないことが示されました(in vitro)。(89ページ*)
- ※1
- ヒト皮質を用いたSV2A受容体親和性試験において、レベチラセタムに比べて30倍高い親和性を示しました(in vitro)。
-
静脈内投与した薬物動態試験において、約2~10分※2で脳内へ移行しました。(78ページ*)
- ※2
- 脳内移行半減時間(補正値)
血漿中トラフ濃度は投与開始後2日目には定常状態に達すると推測されました。(72ページ*)
-
国際共同第Ⅲ相試験(EP0083試験)※3における治療期間の28日あたりの部分発作回数のプラセボ群に対する減少率(主要評価項目)は、50mg/日群24.5%及び200mg/日群33.4%であり、いずれのブリィビアクト群もプラセボ群との間に優越性が検証されました(それぞれp=0.0005及びp<0.0001、ANCOVA※4、検証的解析結果)。(14ページ*)
- ※3
- 全般発作を有する患者が含まれた。
- ※4
- 対数変換した治療期間の28日あたりの部分発作回数(Log[x+1])をアウトカムとし、投与群、国、eCRFデータに基づく実際の層別因子[レベチラセタムの使用状況(使用歴なし、使用歴あり)、過去に使用し試験参加前に中止しているAEDの剤数(2剤以下、3剤以上)]の組み合わせ(4カテゴリー)を固定効果、観察期間の28日あたりの部分発作回数の対数変換値を連続共変量としたANCOVAで解析
-
国際共同第Ⅲ相試験(EP0083試験)における治療期間の部分発作回数の50%レスポンダーレート(副次評価項目)は、プラセボ群19.0%に対し、50mg/日群41.1%、200mg/日群49.3%であり、いずれのブリィビアクト群もプラセボ群との間に統計学的な有意差が認められました[プラセボ群に対するオッズ比:50mg/日群3.079及び200mg/日群4.217、各p<0.0001(名目上のp値)、ロジスティック回帰分析※5]。(16ページ*)
- ※5
- オッズ比と投与群の比較は、投与群、国、eCRFデータに基づく実際の層別因子[レベチラセタムの使用状況(使用歴なし、使用歴あり)、過去に使用し試験参加前に中止しているAEDの剤数(2剤以下、3剤以上)]の組み合わせ(4カテゴリー)を固定効果、観察期間の28日あたりの部分発作回数の対数変換値を連続共変量としたロジスティック回帰分析で解析
-
国際共同第Ⅲ相長期継続投与試験(EP0085試験)の第1回及び第2回中間解析において試験を継続していた被験者の割合はそれぞれ81.6%(169/207例)及び75.8%(157/207例)でした。副作用の発現割合は29.0%(60/207例)でした。主な副作用(3%以上に発現)は、傾眠9.2%、浮動性めまい4.8%でした。(43~44ページ*)
第1回中間解析: 2022年12月14日データカットオフ、試験継続中のすべての被験者が24週以上ブリィビアクトの投与を受けた
第2回中間解析: 2023年6月1日データカットオフ、試験継続中のすべての被験者が48週以上ブリィビアクトの投与を受けた <経口剤>単剤及び併用いずれにおいても臨床推奨用量から投与開始できます。(電子化された添付文書参照)
<静注剤>一時的に経口投与ができない患者におけるブリーバラセタム経口製剤の代替療法として、てんかん患者の部分発作(二次性全般化発作を含む)に対する効能又は効果を有しています。
経口剤(錠剤)の代替療法として、ブリーバラセタムの経口投与から本剤に切り替える場合、経口投与と同じ1日用量及び投与回数にて切り替えが可能であり、急速静脈内投与でも点滴静脈内投与でも投与できます。(電子化された添付文書参照)併用注意は、CYP2C19誘導薬(リファンピシン等)、カルバマゼピン、フェニトイン、アルコール(飲酒)です。(電子化された添付文書参照)
重大な副作用として攻撃性(0.3%)があらわれることがあります。主な副作用(3%以上に発現)として傾眠、浮動性めまい、疲労が報告されています。
電子添文の副作用の項をご参照ください。
*ブリィビアクト錠 総合製品情報概要における記載ページ
ブリィビアクト開発の経緯
ブリィビアクト(ブリーバラセタム)は、レベチラセタム結合部位として同定されたSV2Aへの選択的かつ高親和性のリガンドを特定することを目的としたUCBの創薬プログラムにおいて、約12,000の候補化合物から選択されました。
欧州及び米国等で臨床試験が開始され、2016年に欧州等で、「成人のてんかん部分発作に対する併用療法」として(経口剤51ヵ国、静注用製剤47ヵ国)、また、米国では2017年9月に、「16歳以上の部分発作を有するてんかん患者に対する単剤療法」としても、外挿に基づいて承認を取得しました。
本邦においては、 併用療法と単剤療法の適応を併せて「てんかん患者の部分発作(二次性全般化発作を含む)」を効能又は効果とする製造販売承認申請を行い、2024年6月に承認を取得しました。
- 効能又は効果
- 〈錠〉
- てんかん患者の部分発作(二次性全般化発作を含む)
- 〈静注〉
- 一時的に経口投与ができない患者における、下記の治療に対するブリーバラセタム経口製剤の代替療法
てんかん患者の部分発作(二次性全般化発作を含む)
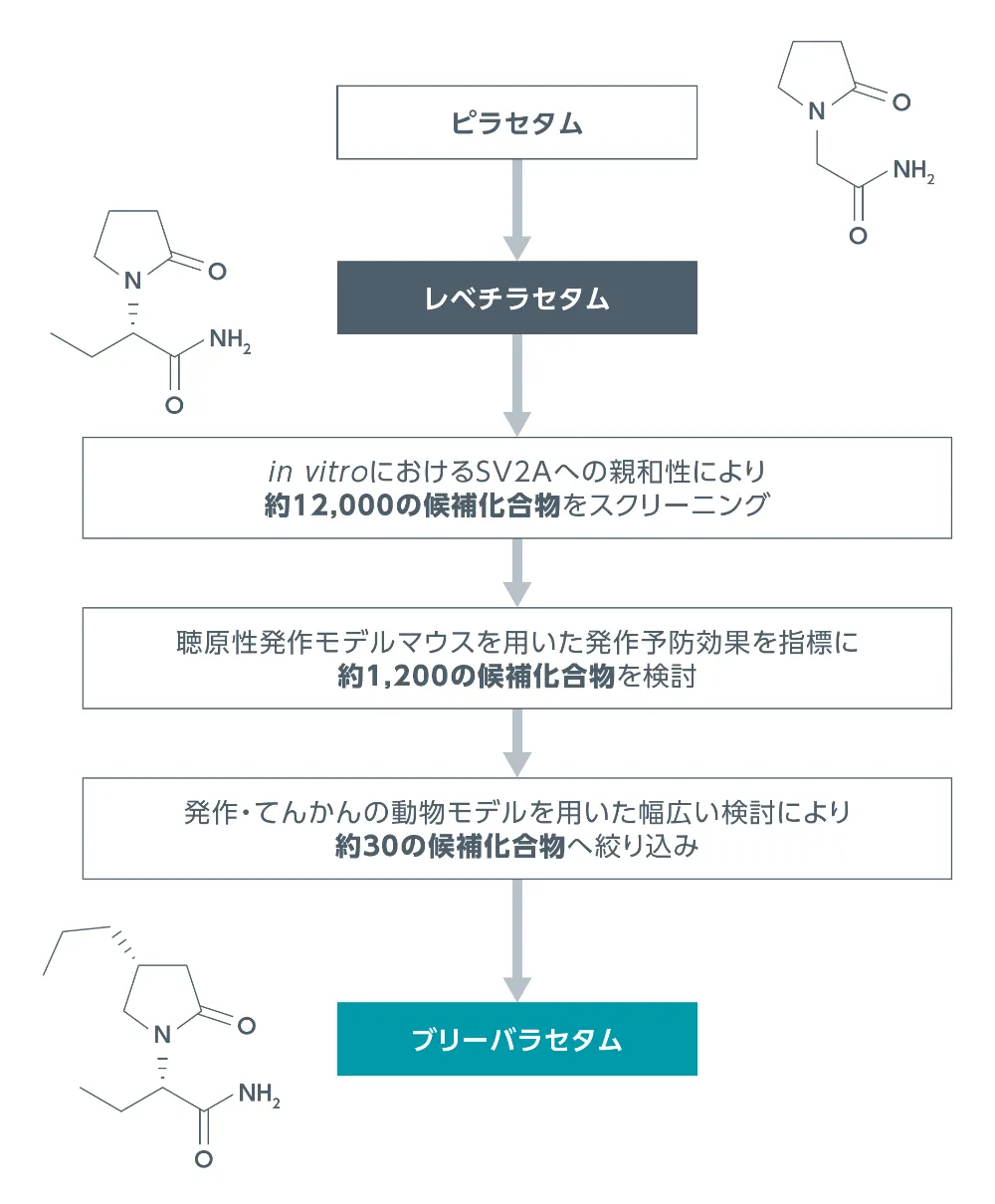
文献1,2より一部改変
1)Kenda BM, et al. J Med Chem. 2004; 47(3): 530-549
2)Klitgaard H, et al. Epilepsia. 2016; 57(4): 538-548
(COI:著者はUCB Pharmaの社員であった。UCB Pharmaの支援により原稿作成された。)
