MG0007試験:有効性
本剤は、一部承認外の用法及び用量による臨床成績で評価され、承認されました。
そのため、承認されている「用法及び用量」と異なるデータが含まれます。
国際共同第Ⅲ相長期継続投与試験(MG0007試験)
- 社内資料
- 国際共同第Ⅲ相長期継続投与試験 MG0007試験(承認時評価資料)
- 社内資料
- 国際共同第Ⅲ相長期継続投与試験 MG0007試験 試験成績の概要(医薬品添付文書改訂相談 相談資料)
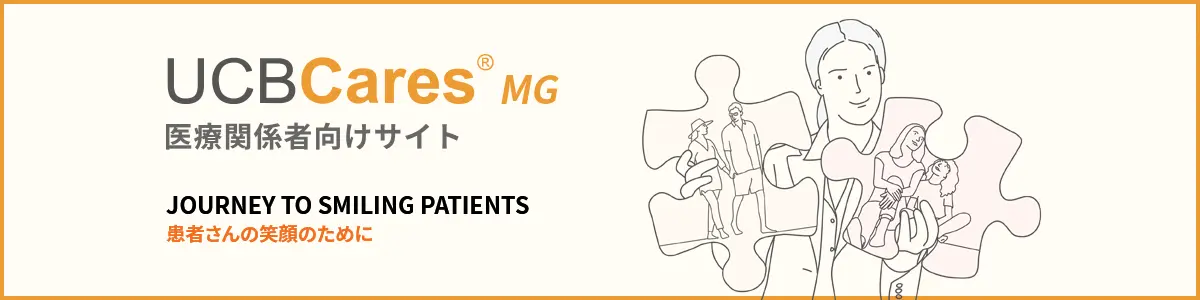
副次評価項目:最初の4回の各治療サイクルにおける、MG-ADL総スコアのベースラインから43日目までの変化量
最初の4サイクルにおける、43日目のMG-ADL総スコアのベースライン(各サイクルの1日目)からの平均変化量は、リスティーゴⓇ7mg/kg群では-2.9~-4.1、リスティーゴⓇ10mg/kg群では-3.1~-3.8でした。
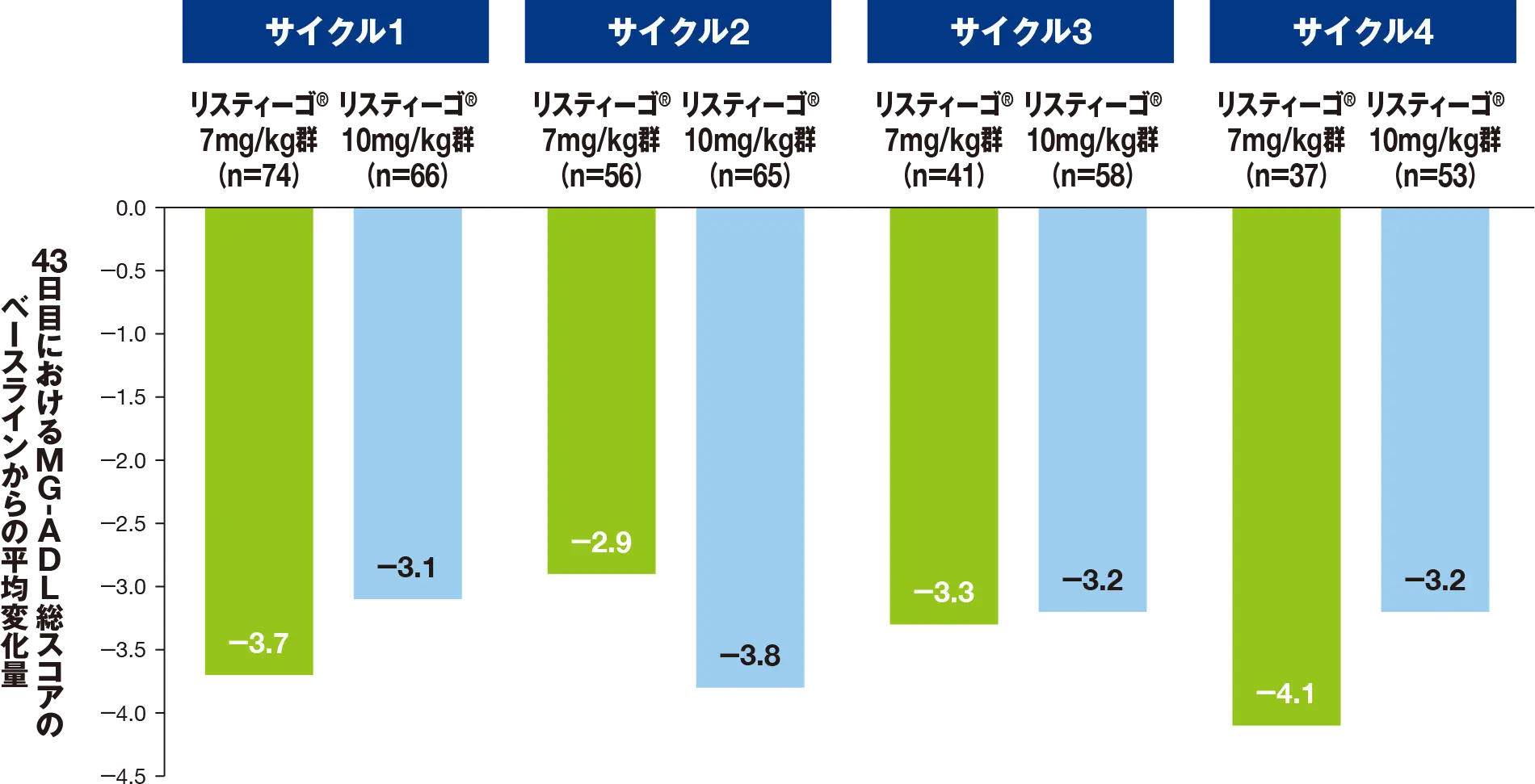
副次評価項目:最初の4回の各治療サイクルにおける、MGC総スコアのベースラインから43日目までの変化量
最初の4サイクルにおける、43日目のMGC総スコアのベースライン(各サイクルの1日目)からの平均変化量は、リスティーゴⓇ7mg/kg群では-5.7~-7.6、リスティーゴⓇ10mg/kg群では-4.7~-7.5でした。
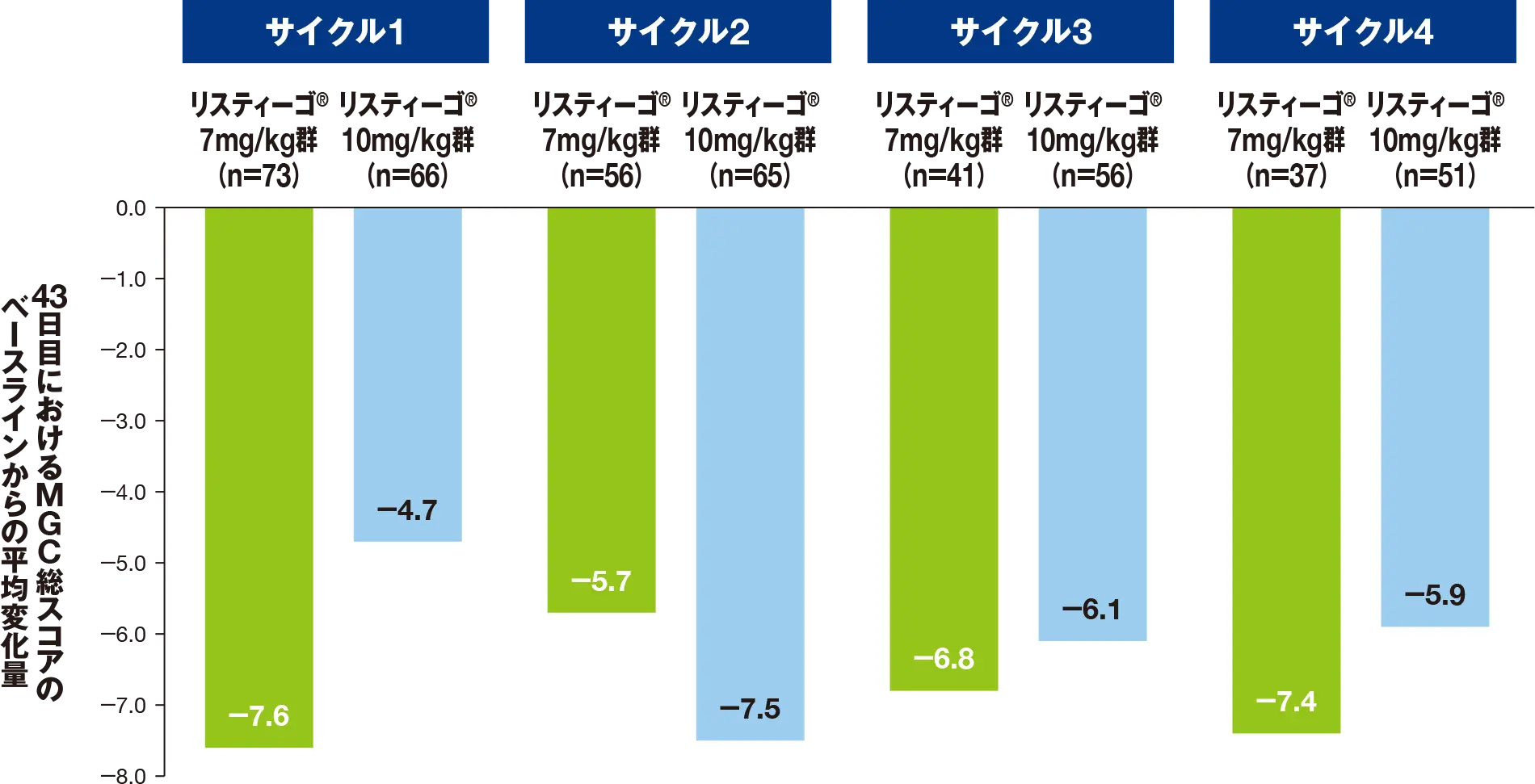
副次評価項目:最初の4回の各治療サイクルにおける、QMG総スコアのベースラインから43日目までの変化量
最初の4サイクルにおける、43日目のQMG総スコアのベースライン(各サイクルの1日目)からの平均変化量は、リスティーゴⓇ7mg/kg群では-3.9~-5.9、リスティーゴⓇ10mg/kg群では-4.1~-4.9でした。
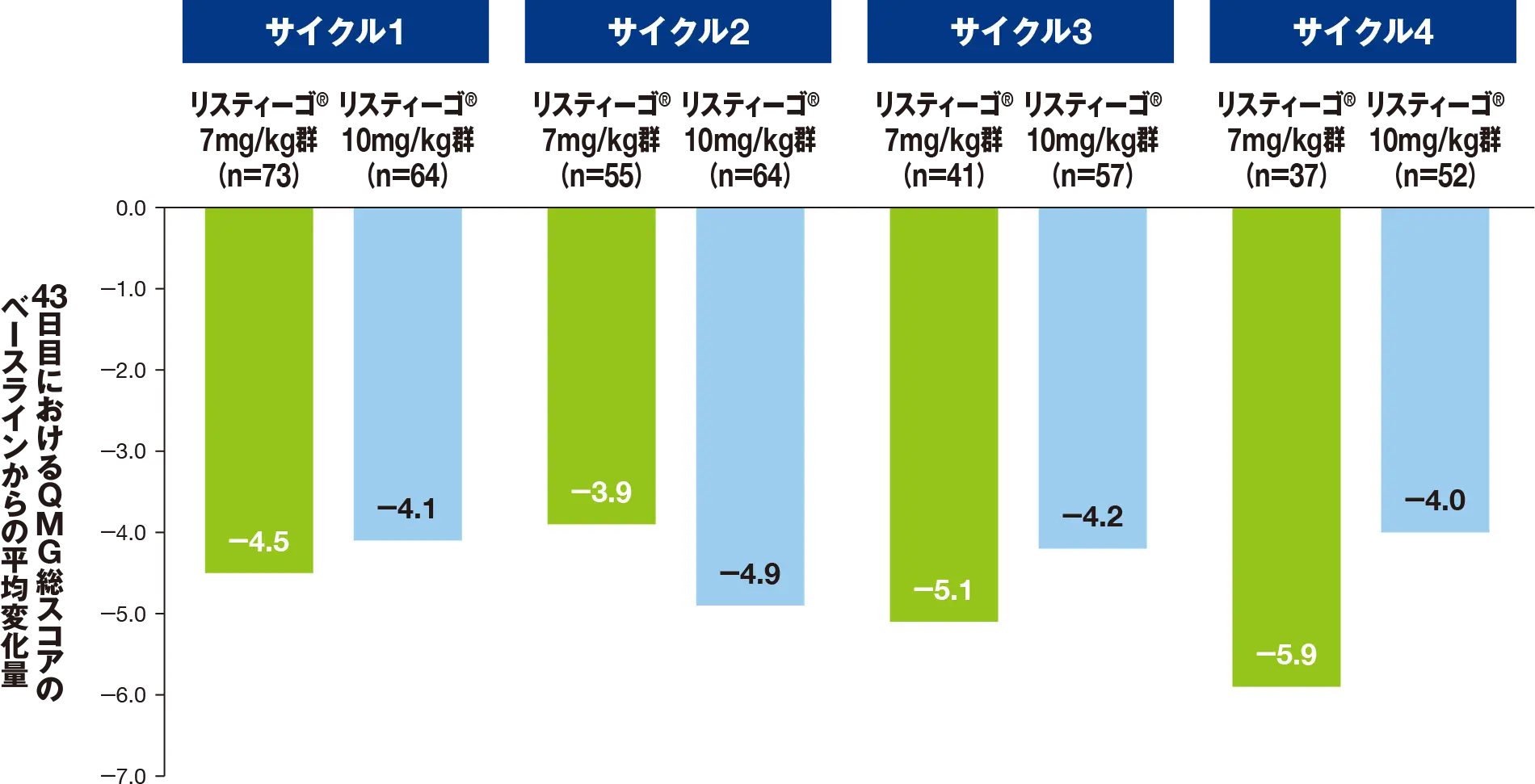
副次評価項目:最初の4回の各治療サイクルにおける、MG症状PROによる「筋力低下疲労」スコアのベースラインから43日目までの変化量
最初の4サイクルにおける、43日目のMG症状PROによる「筋力低下疲労」スコアのベースライン(各サイクルの1日目)からの平均変化量は、リスティーゴⓇ7mg/kg群では-12.8~-19.6、リスティーゴⓇ10mg/kg群では-13.9~-19.2でした。
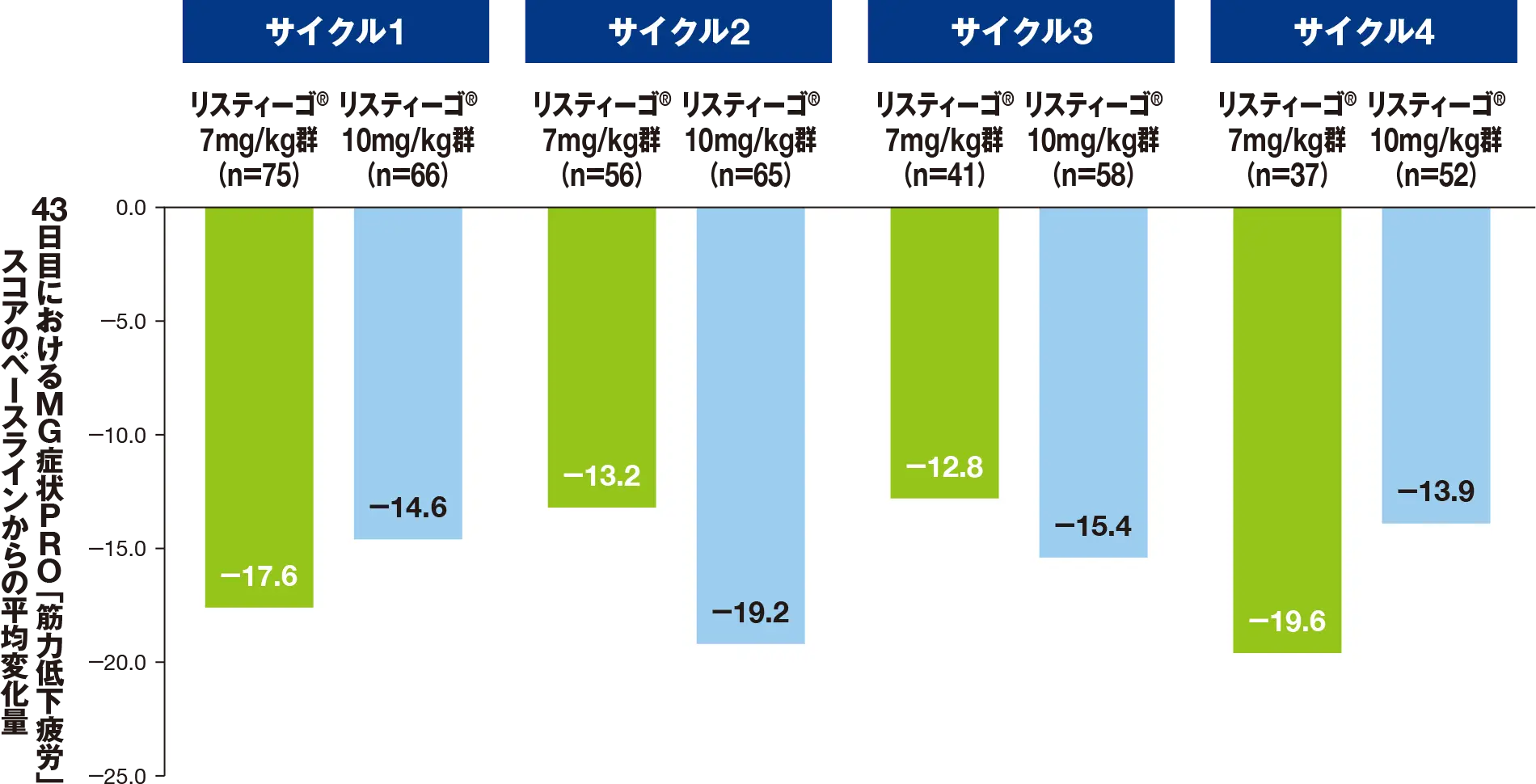
副次評価項目:最初の4回の各治療サイクルにおける、MG症状PROによる「身体疲労」スコアのベースラインから43日目までの変化量
最初の4サイクルにおける、43日目のMG症状PROによる「身体疲労」スコアのベースライン(各サイクルの1日目)からの平均変化量は、リスティーゴⓇ7mg/kg群では-13.6~-16.5、リスティーゴⓇ10mg/kg群では-13.9~-16.0でした。
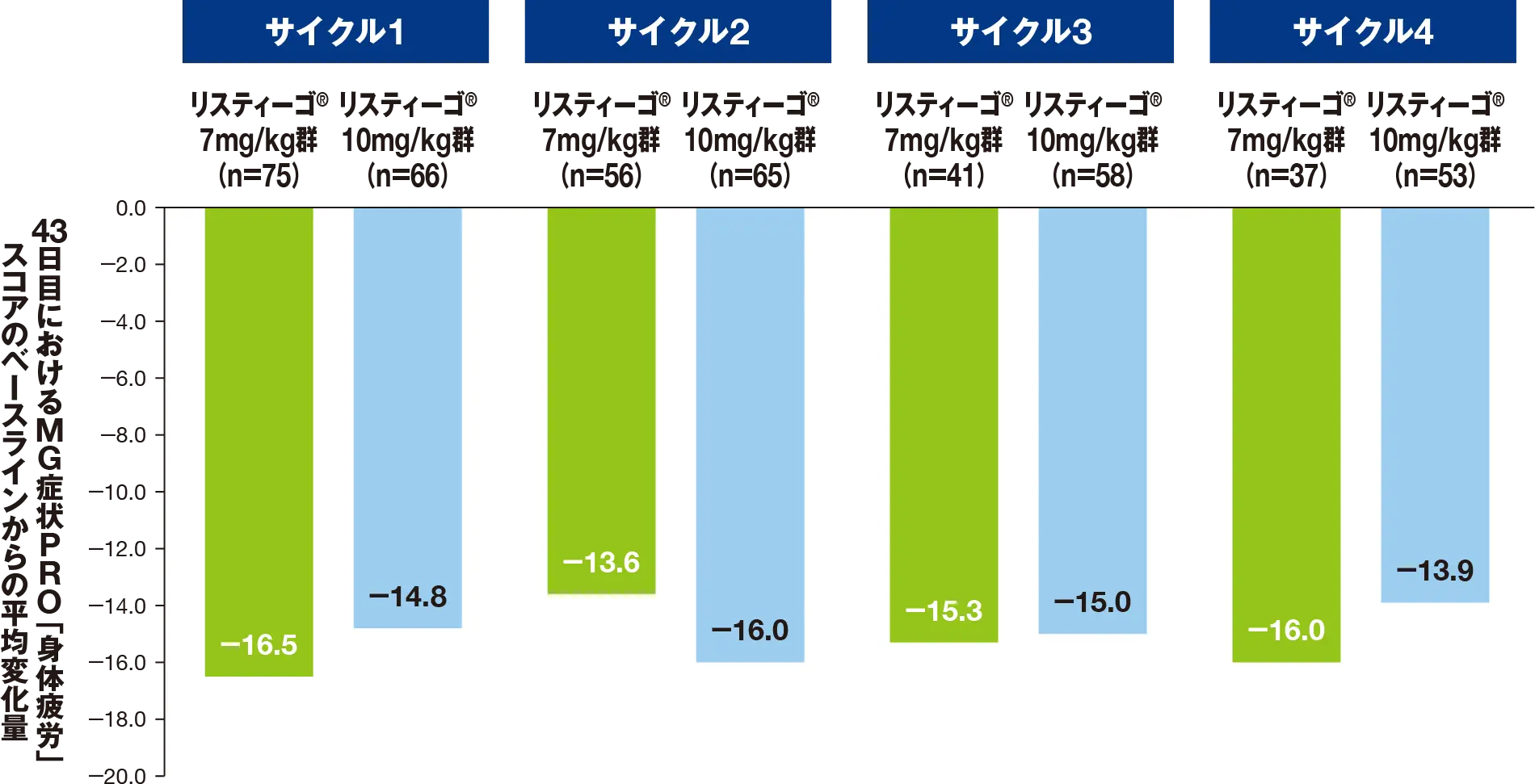
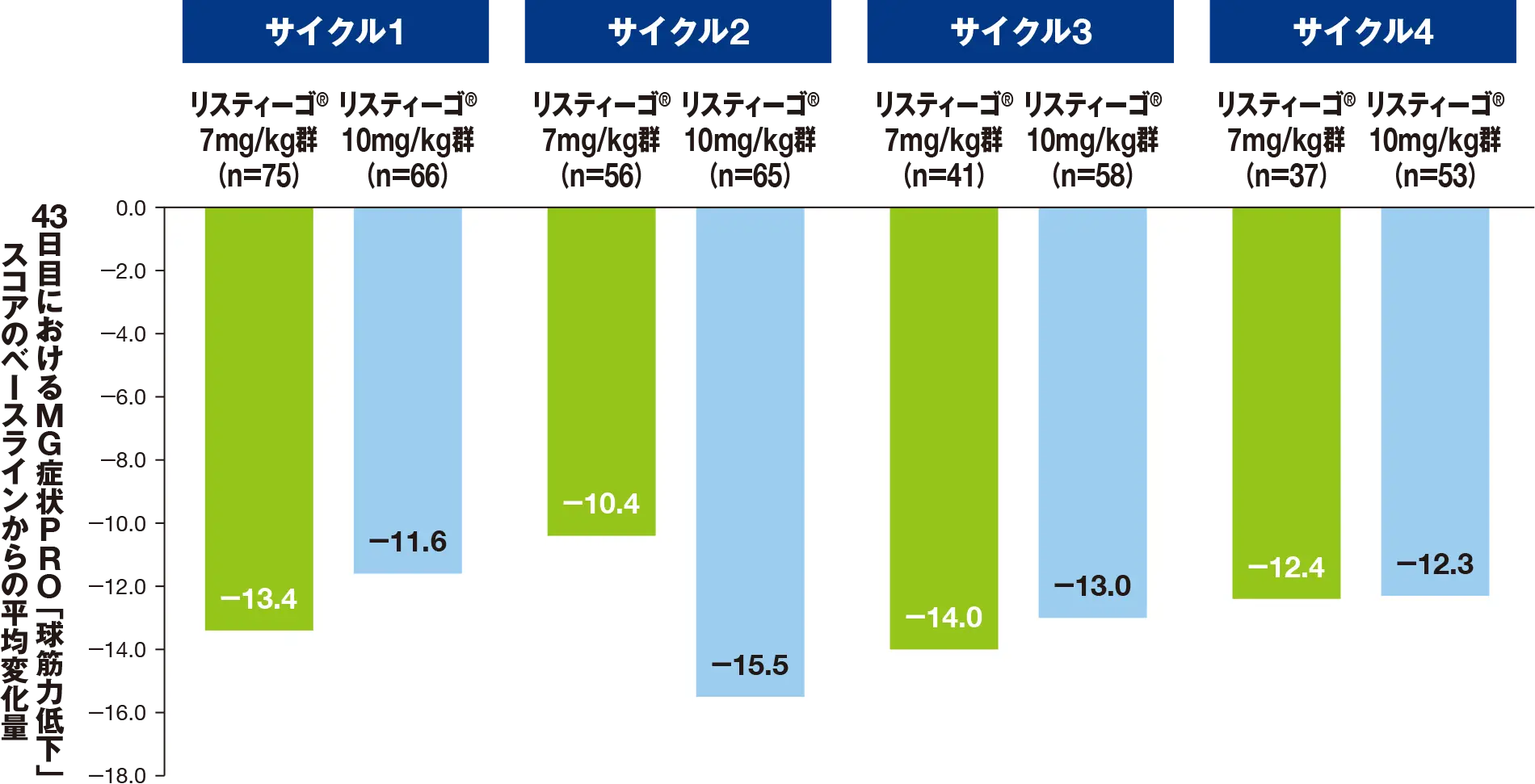
副次評価項目:最初の4回の各治療サイクルにおける、MG症状PROによる「球筋力低下」スコアのベースラインから43日目までの変化量
最初の4サイクルにおける、43日目のMG症状PROによる「球筋力低下」スコアのベースライン(各サイクルの1日目)からの平均変化量は、リスティーゴⓇ7mg/kg群では-10.4~-14.0、リスティーゴⓇ10mg/kg群では-11.6~-15.5でした。
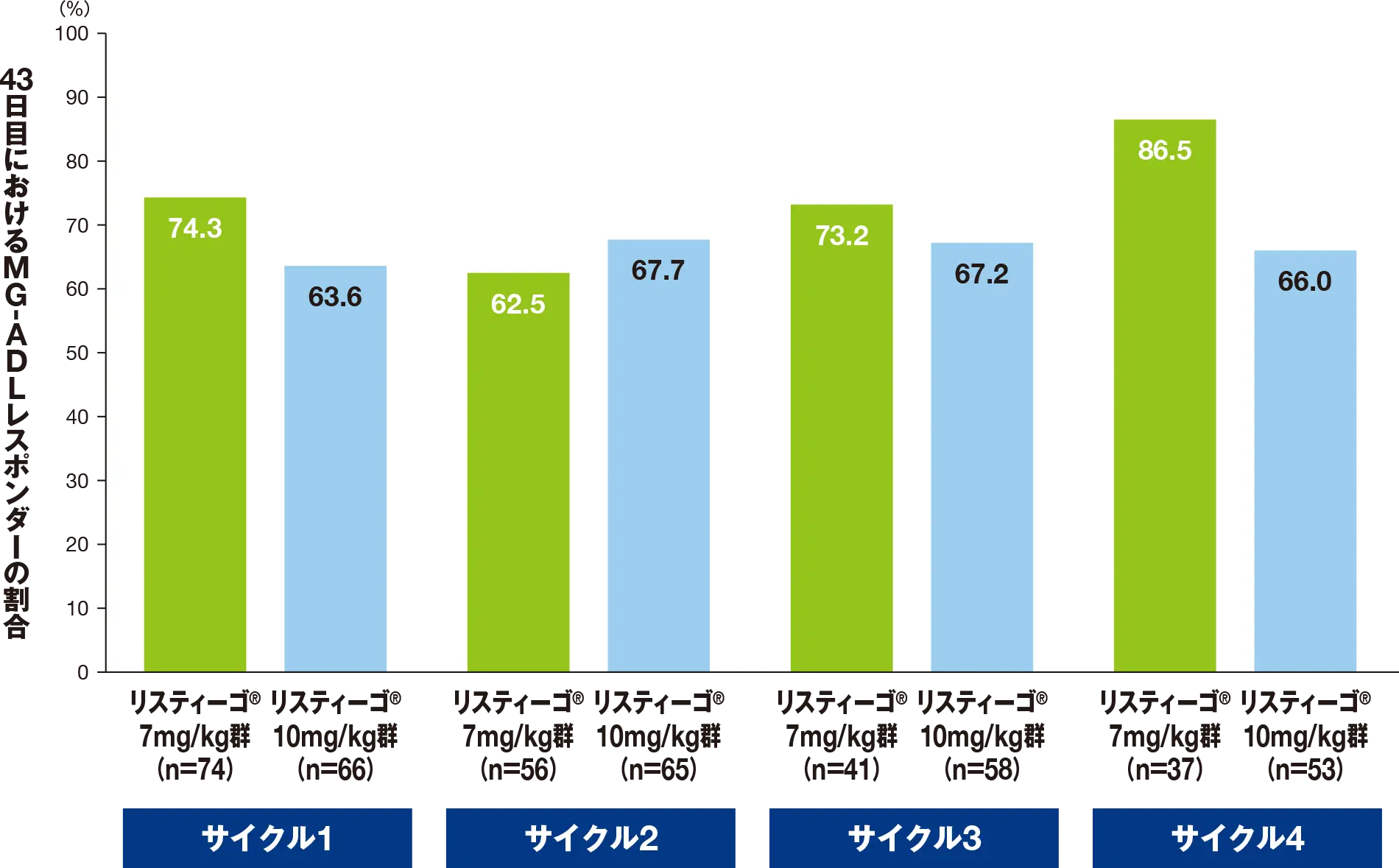
副次評価項目:最初の4回の各治療サイクルにおける、43日目までのMG-ADLレスポンダー※の割合
最初の4サイクルにおける、43日目のMG-ADLレスポンダーの割合は、リスティーゴⓇ7mg/kg群では62.5~86.5%、リスティーゴⓇ10mg/kg群では63.6~67.7%でした。
- ※
- MG-ADLレスポンダーは「ベースラインから2.0点以上の減少」と定義した。
本剤の用法及び用量、特定の背景を有する患者に関する注意は以下の通り(電子添文から抜粋)
- 6.
-
用法及び用量
通常、成人にはロザノリキシズマブ(遺伝子組換え)として下表に示す用量を1週間間隔で6回皮下注射する。これを1サイクルとして、投与を繰り返す。
体重 投与量 50kg未満 280mg 50kg以上70kg未満 420mg 70kg以上100kg未満 560mg 100kg以上 840mg
- 9.
-
特定の背景を有する患者に関する注意(抜粋)
- 9.5
-
妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。IgG抗体は胎盤通過性があることが知られており、本剤は妊娠カニクイザルにおいて、胎児に移行することが確認されたが、新生児に有害な影響は認められなかった。また、本剤の投与を受けた患者からの出生児においては、母体から移行するIgGが低下し、感染のリスクが高まる可能性がある。
- 9.6
-
授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。本剤のヒト乳汁中への移行は不明であるが、ヒト免疫グロブリンは乳汁中に移行することが知られている。