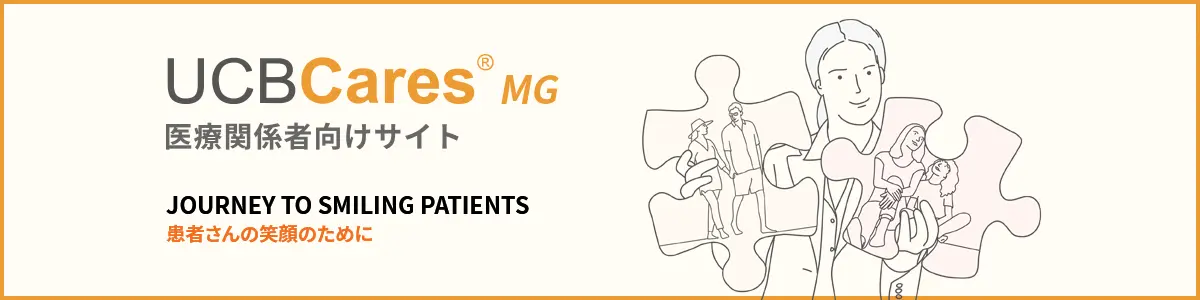
MG0011試験:有効性
本剤は、一部承認外の用法及び用量による臨床試験の成績も含めた臨床データパッケージで評価され、承認されました。
そのため、承認されている「用法及び用量」と異なるデータが含まれます。
国際共同第Ⅲ相非盲検長期継続投与試験(MG0011試験)
- 社内資料
- 国際共同第Ⅲ相非盲検試験成績 MG0011試験(承認時評価資料)
副次評価項目:延長12週におけるMG-ADL総スコアのベースラインからの変化量
延長12週におけるMG-ADL総スコアの先行試験のベースラインからの変化量のLS平均値は、ジルビスクⓇ0.3mg/kg/ 0.3mg/kg群-5.77、プラセボ/ジルビスクⓇ0.3mg/kg群-6.67でした。
| ジルビスクⓇ0.3mg/kg/ 0.3mg/kg群 (n=93) |
プラセボ/ジルビスクⓇ0.3mg/kg群 (n=90) |
|
|---|---|---|
| LS平均値±SE(95%CI)* | -5.77±0.54(-6.83~-4.71) | -6.67±0.86(-8.37~-4.97) |
- *
- ベースラインのMG-ADL及びQMG総スコア、地理的地域、先行試験、並びにベースラインのMG-ADL総スコアと来院の交互作用項を固定効果、患者を変量効果としたMMRM ANCOVAで推定
- E
- 延長
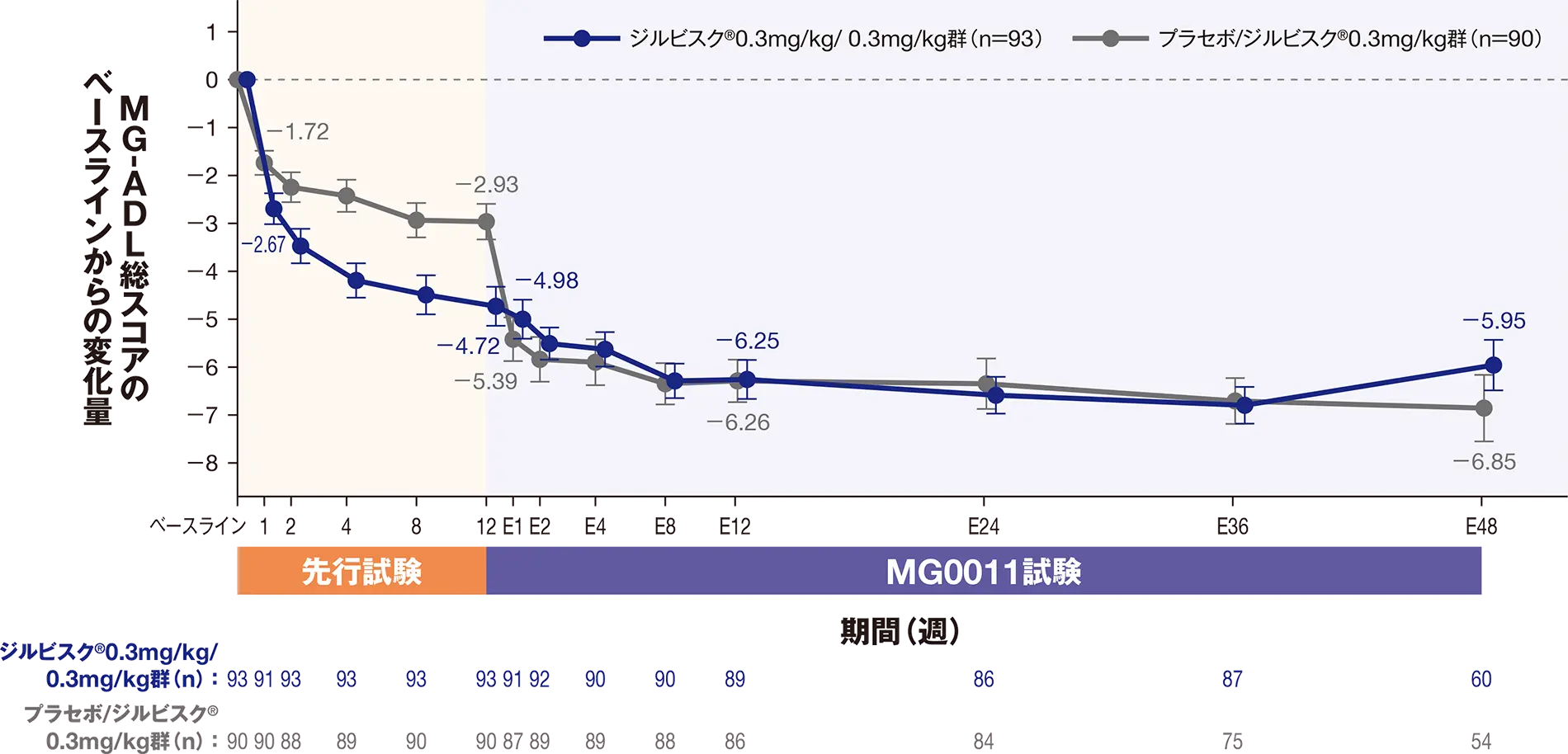
副次評価項目:延長12週におけるQMG総スコアのベースラインからの変化量
延長12週におけるQMG総スコアの先行試験のベースラインからの変化量のLS平均値は、ジルビスクⓇ0.3mg/kg/ 0.3mg/kg群-8.90、プラセボ/ジルビスクⓇ0.3mg/kg群-8.72でした。
| ジルビスクⓇ0.3mg/kg/ 0.3mg/kg群 (n=93) |
プラセボ/ジルビスクⓇ0.3mg/kg群 (n=90) |
|
|---|---|---|
| LS平均値±SE(95%CI)* | -8.90±0.73(-10.33~-7.46) | -8.72±1.20(-11.11~-6.34) |
- *
- ベースラインのMG-ADL及びQMG総スコア、地理的地域、先行試験、並びにベースラインのQMG総スコアと来院の交互作用項を固定効果、患者を変量効果としたMMRM ANCOVAで推定
- E
- 延長
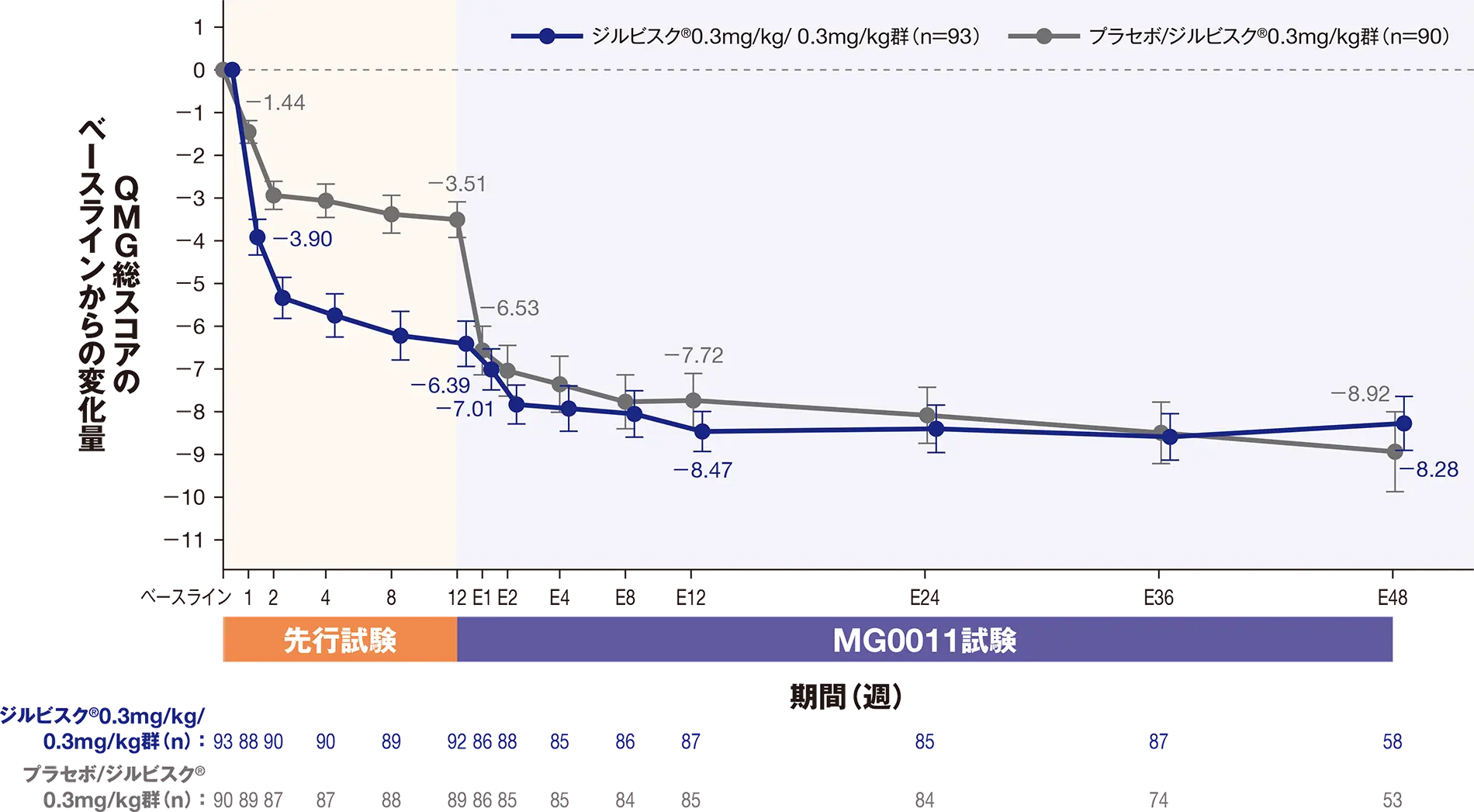
副次評価項目:延長12週におけるMGC総スコアのベースラインからの変化量
延長12週におけるMGC総スコアの先行試験のベースラインからの変化量のLS平均値は、ジルビスクⓇ0.3mg/kg/ 0.3mg/kg群-11.44、プラセボ/ジルビスクⓇ0.3mg/kg群-13.21でした。
| ジルビスクⓇ0.3mg/kg/ 0.3mg/kg群 (n=93) |
プラセボ/ジルビスクⓇ0.3mg/kg群 (n=90) |
|
|---|---|---|
| LS平均値±SE(95%CI)* | -11.44±1.02(-13.46~-9.41) | -13.21±1.71(-16.59~-9.83) |
- *
- ベースラインのMGC、MG-ADL、及びQMG総スコア、地理的地域、先行試験、並びにベースラインのMGC総スコアと来院の交互作用項を固定効果、患者を変量効果としたMMRM ANCOVAで推定
- E
- 延長
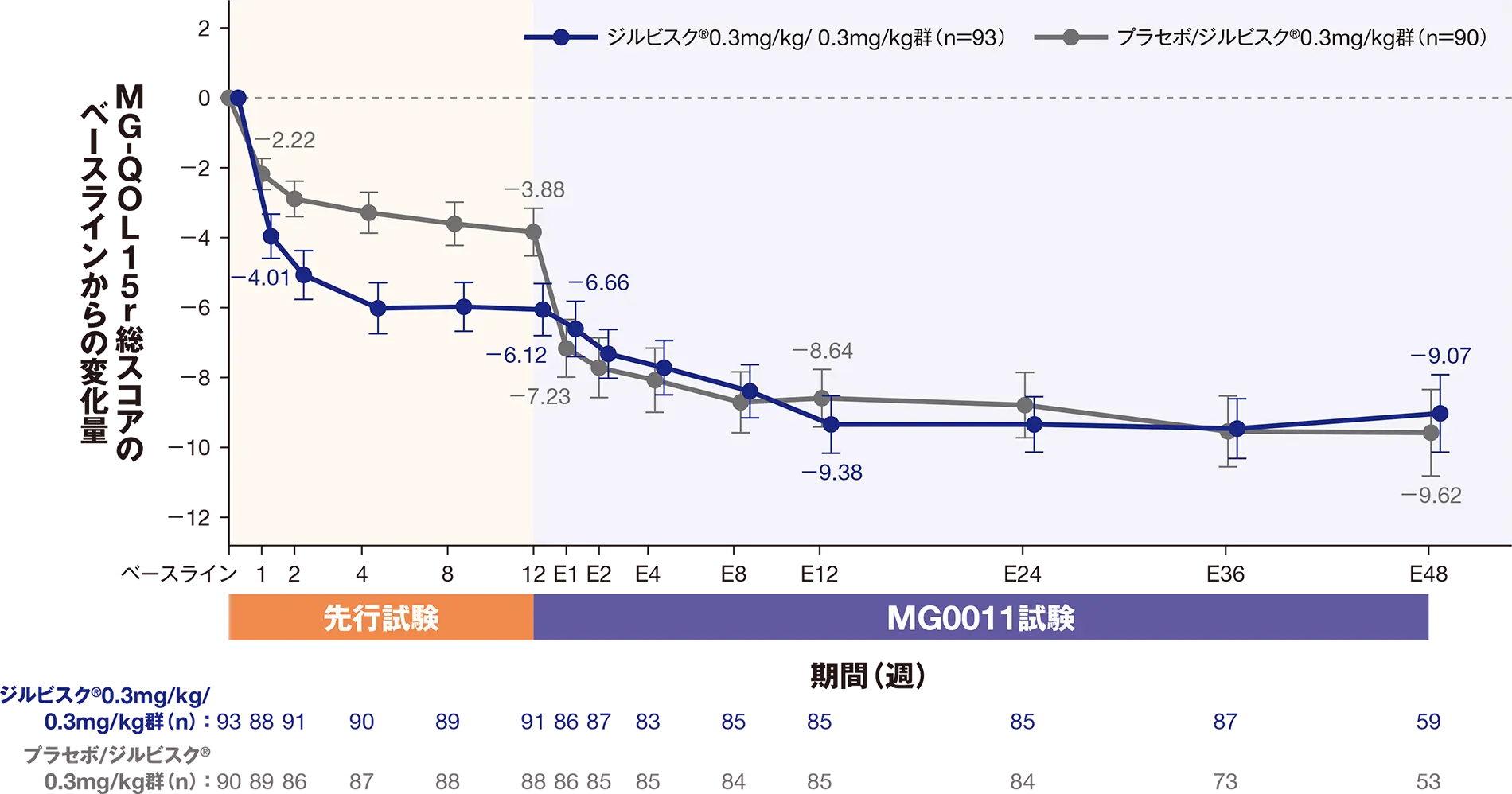
副次評価項目:延長12週におけるMG-QOL15r総スコアのベースラインからの変化量
延長12週におけるMG-QOL15r総スコアの先行試験のベースラインからの変化量のLS平均値は、ジルビスクⓇ0.3mg/kg/ 0.3mg/kg群-8.95、プラセボ/ジルビスクⓇ0.3mg/kg群-8.27でした。
| ジルビスクⓇ0.3mg/kg/ 0.3mg/kg群 (n=93) |
プラセボ/ジルビスクⓇ0.3mg/kg群 (n=90) |
|
|---|---|---|
| LS平均値±SE(95%CI)* | -8.95±1.10(-11.13~-6.76) | -8.27±1.59(-11.42~-5.13) |
- *
- ベースラインのMG-QOL15r、MG-ADL及びQMG総スコア、地理的地域、先行試験、並びにベースラインのMG-QOL15r総スコアと来院の交互作用項を固定効果、患者を変量効果としたMMRM ANCOVAで推定
- E
- 延長
本剤の用法及び用量、用法及び用量に関連する注意等は以下の通り(電子添文から抜粋)
- 6.
-
用法及び用量
通常、成人にはジルコプランとして下表に示す用量を1日1回皮下投与する。
体重 投与量 56kg未満 16.6mg 56kg以上77kg未満 23.0mg 77kg以上 32.4mg - 7.
-
用法及び用量に関連する注意
本剤投与開始12週後までに症状の改善が認められない患者では、他の治療法への切り替えを考慮すること。
- 9.
-
特定の背景を有する患者に関する注意(抜粋)
- 9.5
-
妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
- 9.6
-
授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。