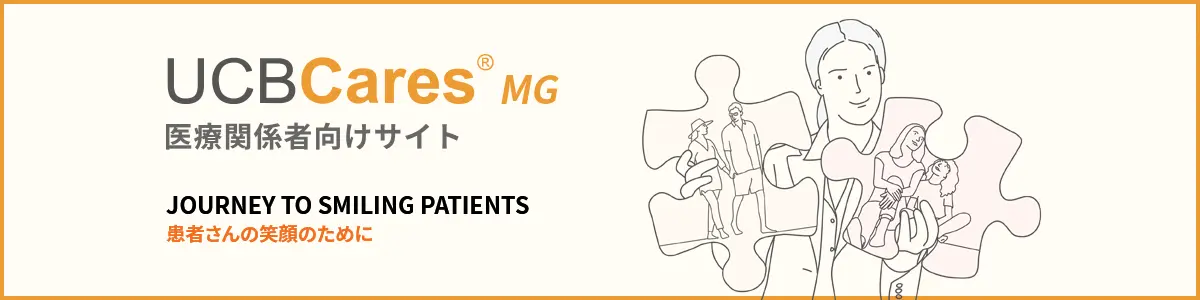
MG0011試験:試験概要
本剤は、一部承認外の用法及び用量による臨床試験の成績も含めた臨床データパッケージで評価され、承認されました。
そのため、承認されている「用法及び用量」と異なるデータが含まれます。
国際共同第Ⅲ相非盲検長期継続投与試験(MG0011試験)
- 社内資料
- 国際共同第Ⅲ相非盲検試験成績 MG0011試験(承認時評価資料)
試験概要
- 目的
-
全身型重症筋無力症(gMG)患者におけるジルビスクⓇの長期有効性、安全性及び忍容性を評価する。
- 対象
-
先行試験(MG0009試験及びMG0010試験)を完了したgMG患者200例(日本人患者16例を含む)
ジルビスクⓇ0.1mg/kg/ 0.1mg/kg/ 0.3mg/kg群:12例、ジルビスクⓇ0.3mg/kg/ 0.3mg/kg群:93例
プラセボ/ジルビスクⓇ0.1mg/kg/ 0.3mg/kg群:5例、プラセボ/ジルビスクⓇ0.3mg/kg群:90例
- 試験デザイン
-
第Ⅲ相、多施設共同(米国、カナダ、フランス、ドイツ、イタリア、ノルウェー、ポーランド、スペイン、英国、日本)、非盲検、継続投与試験
- 投与方法
-
ジルビスクⓇ0.3mg/kgを1日1回、ジルビスクⓇが承認され入手可能になるまで、又は治験依頼者がgMG治療薬としてのジルビスクⓇの開発を中止するまで皮下投与した。ジルビスクⓇは、下表に示す体重区分に従って各患者の体重に応じた固定量のジルビスクⓇを含む自己投与用のプレフィルドシリンジ製剤として供給した。体重の重い患者(150kg超)又は軽い患者(43kg未満)については、メディカルモニターと相談のうえ個別に対応した。
最小目標用量(名目上)(mg/kg) 投与量(kg) 体重区分(kg) 用量範囲(mg/kg) 0.3 16.6 ≧43~<56 0.30~0.39 0.3 23.0 ≧56~<77 0.30~0.41 0.3 32.4 ≧77~150 0.22~0.42 - 評価項目
-
- 主要評価項目
-
- 治験薬投与後に発現した有害事象(TEAE)の発現割合
- 副次評価項目
-
- 延長12週におけるMG-ADL総スコアのベースラインからの変化量
- 延長12週におけるQMG総スコアのベースラインからの変化量
- 延長12週におけるMGC総スコアのベースラインからの変化量
- 延長12週におけるMG-QOL15r総スコアのベースラインからの変化量
- レスキュー療法の使用状況
- 探索的評価項目
-
- レスキュー療法を受けずに延長12週にMGFA-PISのMMを達成した患者の割合
- 延長12週におけるWPAI:SHPのベースラインからの変化量
- 延長12週におけるEQ-5D-5L及びVASのベースラインからの変化量
- 延長12週におけるNeuro-QOL SF Fatigueスコアのベースラインからの変化量
- MG-ADL及びQMG総スコアのレスポンダー解析(レスキュー療法を受けなかった患者におけるベースラインからの変化量)
- MSEを達成した患者の割合、など
- 解析計画
-
ITT(intention to treat)集団、mITT集団、及びCFS(COVID-19 Free Set)を対象に、先行試験で無作為化された投与及び本試験で計画された投与(ジルビスクⓇ0.3mg/kg)に基づき解析し、以下に示す投与別に要約した。
- プラセボ/ジルビスクⓇ0.1mg/kg/ 0.3mg/kg群
- プラセボ/ジルビスクⓇ0.3mg/kg群
- ジルビスクⓇ0.1mg/kg/ 0.1mg/kg/ 0.3mg/kg群
- ジルビスクⓇ0.3mg/kg/ 0.3mg/kg群
- 全ジルビスクⓇ投与群
ITT集団は、登録されたすべての患者、mITT集団は、登録されたすべての患者のうち、治験薬を1回以上投与され、治験薬投与後1時点以上のMG-ADL総スコアを有する患者と定義した。
有効性は、mITT集団及びCFSを対象に副次評価項目を解析し、mITT集団を対象に探索的解析を実施した。
延長12週におけるMG-ADL総スコアのベースラインからの変化量について、ベースラインのMG-ADL及びQMG総スコア、地理的地域(北米、欧州、及び日本)、先行試験、並びにMG-ADL総スコアと来院の交互作用項を固定効果、患者をランダム効果としたMMRM ANCOVAで評価した。プラセボ/ジルビスクⓇ0.3mg/kg群及びジルビスクⓇ0.3mg/kg/ 0.3mg/kg群を対象に、上記のMMRM ANCOVAを用いて、先行試験二重盲検期の1~12週及び本試験の延長1~12週のデータを評価した。各投与群の評価に個別のモデルを適用した。QMG、MGC、及びMG-QOL15r総スコアについても同様に解析した。MG-ADL、QMG、MGC、及びMG-QOL15r総スコアについて、二重盲検下ベースラインから最長で延長48週までの変化量の平均値を図示した。
非盲検投与期間における初回のレスキュー療法までの時間は、Time-to-Event解析を実施し、Kaplan-Meierプロットで図示した。
安全性はSS(治験薬を1回以上投与されたすべての患者)を対象に解析した。非盲検継続投与期での治験薬初回投与日(MG0010試験から移行した患者は本試験での治験薬初回投与日、MG0009試験から移行した患者はMG0009試験の非盲検継続パートでの治験薬初回投与日)から治験薬最終投与40日後までに発現した有害事象(AE)を治験薬投与後に発現した有害事象(TEAE)と定義し、発現した患者数及びその割合を投与群別に要約した(MedDRA ver. 24.0を用いて集計)。
TEAEの安全性解析、及び有効性の副次評価項目について、サブグループ解析※を実施した。治療抵抗性集団の解析は、MG0010試験から移行した患者のみを対象とした。
- 注)
- 本試験は現在継続中であり、当Webサイトでは、2022年9月8日の臨床データカットオフ日に基づく中間解析報告書から中間解析結果を紹介する(承認時)。
- ※
- 年齢、性別、ベースライン時の罹病期間、ベースライン時のMGFA分類、ベースライン時のMG-ADLスコア、ベースライン時のQMG総スコア、地理的地域、民族、治療抵抗性の有無、クリーゼの既往の有無、胸腺摘除術歴の有無、ステロイドによる治療歴の有無、ベースライン時のステロイドの使用の有無、免疫抑制剤による治療歴の有無(ステロイドを除く)、ベースライン時の免疫抑制剤(ステロイドを除く)使用の有無、IVIg、SCIg、又はPLEXによる治療歴の有無、胸腺腫の診断の有無、COVID-19流行期における登録タイミングなど
- 患者背景
-
人口統計学的特性 ジルビスクⓇ
0.1mg/kg/
0.1mg/kg/
0.3mg/kg群
(n=12)ジルビスクⓇ
0.3mg/kg/
0.3mg/kg群
(n=93)プラセボ/ジルビスクⓇ
0.1mg/kg/
0.3mg/kg群
(n=5)プラセボ/ジルビスクⓇ
0.3mg/kg群
(n=90)全ジルビスクⓇ
投与群
(n=200)性別、n(%) 性別、n(%) 男性 6(50.0) 41(44.1) 1(20.0) 42(46.7) 90(45.0) 女性 6(50.0) 52(55.9) 4(80.0) 48(53.3) 110(55.0) 人種、n(%) 人種、n(%) アジア人 0 8(8.6) 0 15(16.7) 23(11.5) 黒人 2(16.7) 8(8.6) 0 7(7.8) 17(8.5) 白人 10(83.3) 72(77.4) 5(100) 65(72.2) 152(76.0) 不明 0 5(5.4) 0 3(3.3) 8(4.0) 年齢、歳 年齢、歳 平均値(SD) 50.4(15.3) 52.9(14.5) 60.6(14.8) 53.7(15.5) 53.3(15.0) 中央値(最小値、最大値) 56.5(23、69) 55.0(21、75) 63.0(36、76) 56.0(19、75) 56.0(19、76) MGFA分類、n(%) MGFA分類、n(%) クラスII(IIa、IIb) 3(25.0) 25(26.9) 2(40.0) 29(32.2) 59(29.5) クラスIII(IIIa、IIIb) 9(75.0) 60(64.5) 3(60.0) 57(63.3) 129(64.5) クラスIV(IVa、IVb) 0 8(8.6) 0 4(4.4) 12(6.0) 発症時年齢、歳※1 発症時年齢、歳※1 平均値(SD) 38.58(16.46) 43.43(17.61) 52.60(12.66) 44.03(18.70) 43.64(17.94) 中央値(最小値、最大値) 34.50(17.0、63.0) 43.50(13.0、73.0) 56.00(31.0、63.0) 44.50(9.0、73.0) 44.00(9.0、73.0) 不明 0 1 0 0 1 罹病期間、年 罹病期間、年 平均値(SD) 11.53(8.19) 9.35(9.36) 7.30(8.09) 9.25(10.45) 9.38(9.73) 中央値(最小値、最大値) 9.00(3.3、26.0) 5.70(0.2、42.3) 3.30(2.7、21.6) 4.85(0.2、51.9) 5.70(0.2、51.9) 胸腺摘除術歴有り、n(%) 胸腺摘除術歴有り、n(%) 7(58.3) 49(52.7) 1(20.0) 39(43.3) 96(48.0) 治療抵抗性gMG、n(%)※2,3 治療抵抗性gMG、n(%)※2,3 ― 43(52.4) ― 42(50.0) 85(51.2) MG-ADL総スコア MG-ADL総スコア 平均値(SD) 4.3(3.1) 5.2(3.9) 6.4(1.5) 7.7(4.5) 6.3(4.3) 中央値(最小値、最大値) 4.5(0、10) 4.0(0、14) 6.0(5、8) 8.0(0、20) 6.0(0、20) QMG総スコア QMG総スコア 平均値(SD) 13.4(6.0) 12.5(5.6) 12.6(2.7) 15.6(6.0) 14.0(5.9) 中央値(最小値、最大値) 11.5(7、25) 12.0(0、37) 13.0(9、16) 15.0(2、38) 14.0(0、38) - ※1
- ジルビスクⓇ0.3mg/kg/ 0.3mg/kg群:n=92、全ジルビスクⓇ投与群:n=199
- ※2
- MG0009試験では患者の治療抵抗性の状態が記録されていない。
- ※3
- 以下のいずれかの基準に該当した患者を治療抵抗性と定義:
Prednisone(本邦未承認)、アザチオプリン*、ミコフェノール酸*、シクロスポリン、シクロホスファミド*、メトトレキサート*、タクロリムス、リツキシマブ*、エクリズマブ、その他のコルチコステロイド、及びその他の免疫抑制療法のうち2種類以上の治療を1年以上受けている者
上記のうち1種類以上の治療を1年以上受けており、かつ本試験登録の12ヵ月前からPLEX、IVIg、又はSCIgを少なくとも3ヵ月間隔で受けている者
- *
- MGの治療に対し、本邦未承認
gMGに対する前治療薬の概要(全体の10%以上で使用)(ITT) ジルビスクⓇ
0.1mg/kg/
0.1mg/kg/
0.3mg/kg群
(n=12)ジルビスクⓇ
0.3mg/kg/
0.3mg/kg群
(n=93)プラセボ/ジルビスクⓇ
0.1mg/kg/
0.3mg/kg群
(n=5)プラセボ/ジルビスクⓇ
0.3mg/kg群
(n=90)全ジルビスクⓇ
投与群
(n=200)Prednisone※1 10(83.3) 85(91.4) 5(100) 75(83.3) 175(87.5) その他のコルチコステロイド 2(16.7) 23(24.7) 0 21(23.3) 46(23.0) アザチオプリン※2 5(41.7) 35(37.6) 1(20.0) 38(42.2) 79(39.5) ミコフェノール酸※2 8(66.7) 34(36.6) 3(60.0) 30(33.3) 75(37.5) IVIg 7(58.3) 61(65.6) 1(20.0) 62(68.9) 131(65.5) IVIg、SCIg、又はPLEX 10(83.3) 65(69.9) 2(40.0) 68(75.6) 145(72.5) シクロスポリン 2(16.7) 11(11.8) 0 11(12.2) 24(12.0) タクロリムス 0 10(10.8) 0 12(13.3) 22(11.0) リツキシマブ※2 2(16.7) 6(6.5) 0 12(13.3) 20(10.0) 抗コリンエステラーゼ薬 12(100) 91(97.8) 5(100) 86(95.6) 194(97.0) 例数(%)
- ※1
- 本邦未承認
- ※2
- MGの治療に対し、本邦未承認
ベースラインにおけるgMG治療薬の使用状況(全体の10%以上で使用)(ITT) ジルビスクⓇ
0.1mg/kg/
0.1mg/kg/
0.3mg/kg群
(n=12)ジルビスクⓇ
0.3mg/kg/
0.3mg/kg群
(n=93)プラセボ/ジルビスクⓇ
0.1mg/kg/
0.3mg/kg群
(n=5)プラセボ/ジルビスクⓇ
0.3mg/kg群
(n=90)全ジルビスクⓇ
投与群
(n=200)Prednisone※1 6(50.0) 40(43.0) 4(80.0) 35(38.9) 85(42.5) その他のコルチコステロイド 1(8.3) 20(21.5) 0 18(20.0) 39(19.5) アザチオプリン※2 1(8.3) 15(16.1) 1(20.0) 15(16.7) 32(16.0) ミコフェノール酸※2 4(33.3) 18(19.4) 2(40.0) 19(21.1) 43(21.5) 抗コリンエステラーゼ薬 10(83.3) 79(84.9) 5(100) 73(81.1) 167(83.5) 例数(%)
- ※1
- 本邦未承認
- ※2
- MGの治療に対し、本邦未承認
本剤の用法及び用量、用法及び用量に関連する注意等は以下の通り(電子添文から抜粋)
- 6.
-
用法及び用量
通常、成人にはジルコプランとして下表に示す用量を1日1回皮下投与する。
体重 投与量 56kg未満 16.6mg 56kg以上77kg未満 23.0mg 77kg以上 32.4mg - 7.
-
用法及び用量に関連する注意
本剤投与開始12週後までに症状の改善が認められない患者では、他の治療法への切り替えを考慮すること。
- 9.
-
特定の背景を有する患者に関する注意(抜粋)
- 9.5
-
妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
- 9.6
-
授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。