重症筋無力症(MG)の病因
MGは、病原性IgG自己抗体によって生じる自己免疫疾患です。病原性IgG自己抗体は、シナプス後膜上の運動終板にある特定のタンパク質を標的とし、神経筋接合部でのシナプス伝達を阻害します1,2)。
現在、MGの病因として認められている自己抗体は抗アセチルコリン受容体(AChR)抗体と抗筋特異的受容体型チロシンキナーゼ(MuSK)抗体の2つです3)。3番目の候補として、低密度リポタンパク質受容体関連蛋白質4(LRP4)抗体4)も検討されてきましたが、疾患特異性が低いことから、国内のガイドラインにおいて「病原性自己抗体であると結論するエビデンスレベルに達していない」と判断されました3)。
抗AChR抗体及び抗MuSK抗体のいずれも陰性のMGはdouble seronegative(DS-MG)と分類され、DS-MGには抗体が検出不能のMG5)、LRP4抗体あるいは未知の自己抗体陽性のMGが含まれます3)。
国内の13施設、1,710例のMG患者を対象とした多施設共同横断的調査であるJapan MG registry(JAMG-R)の2021年調査の報告によると、抗AChR抗体陽性の患者割合は82%、抗MuSK抗体陽性は3%でした6)。
重症筋無力症(MG)の疫学
2017年に受診したMG患者を対象とした全国疫学調査によると、患者数は29,210人、人口10万人あたりの有病率は23.1人と推定されました。2006年の調査から11年で約2倍に増加しています7)。
-
全国疫学調査による推定患者数7)
- 2006年
- 15,100人(男女比 1:1.7)
- 2017年
- 29,210人(男女比 1:1.15)
-
有病率(人口10万人あたり)7)
- 2006年
- 11.8人
- 2017年
- 23.1人
-
特定医療費(指定難病)受給者証所持者数8)
令和3年度末現在 25,568人(重症筋無力症)
同調査によると、発症年齢中央値 (IQR) は59歳 (43~70歳) でした。男女別にみると、男性の発症年齢中央値 (IQR) は60歳 (49~69歳)、女性は58歳 (40~72歳) でした7)。
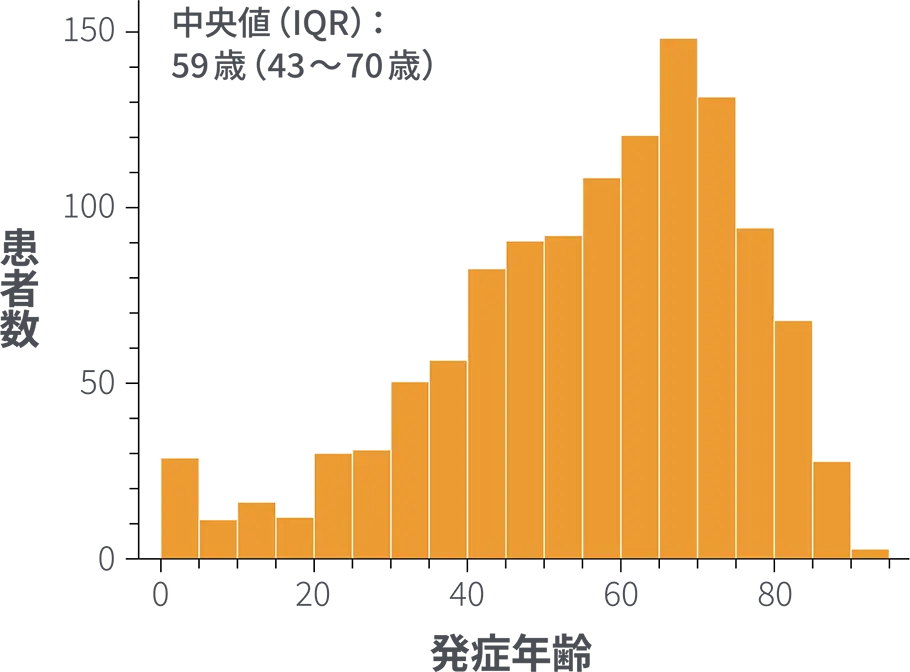
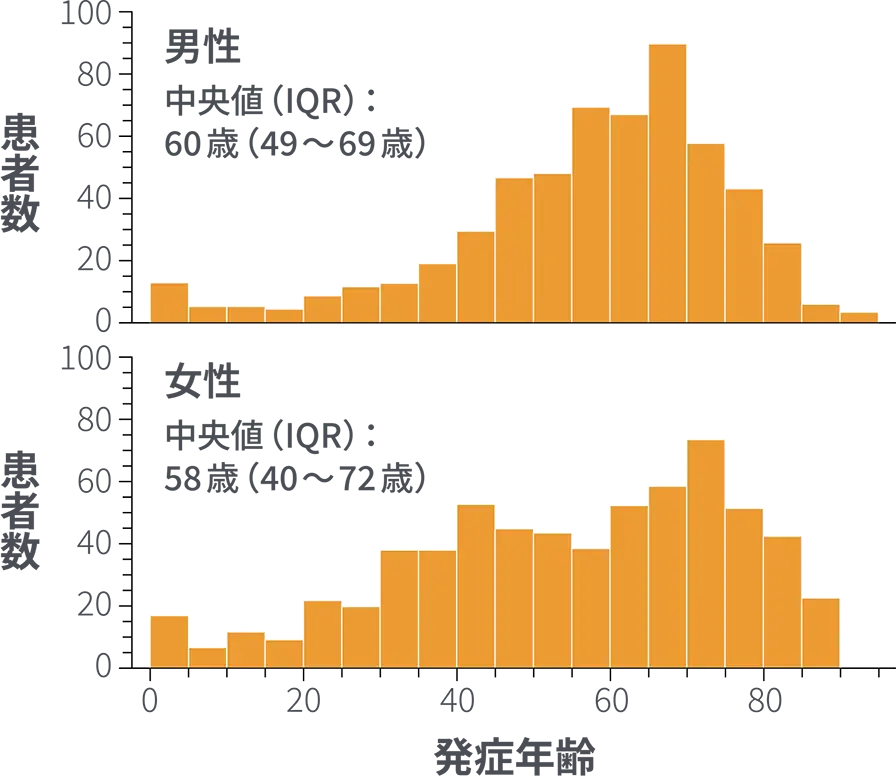
Yoshikawa H et al: PLoS One. 2022; 17(9): e0274161
https://creativecommons.org/licenses/by/4.0/
重症筋無力症(MG)の症状
最も特徴的な症状は骨格筋の易疲労性を伴う筋力低下です。運動の反復によって筋力が低下し、休息によって回復します。また、日差変動、日内変動を伴い、一般的に夕方に悪化します1,3)。
初発症状として最も高頻度で発現するのは眼症状で、国内の調査によると眼瞼下垂が71.9%、複視が47.3%にみられました。次いで 四肢筋力低下(23.1%)、球症状(14.9%)、顔面筋力低下(5.3%)、呼吸困難(2.3%)の順にみられます1,3)。
-
- 眼筋
-
- 眼瞼下垂
- 複視
-
- 四肢の近位骨格筋
-
- 四肢の近位筋の筋力低下:脚よりも腕でみられる
- 指伸筋の筋力低下
-
- 球筋
-
- 鼻声による構音障害
- 鼻腔逆流を伴う嚥下障害
- 咀嚼障害
-
- 顔面・頸部筋
-
- 顔の表情が乏しい
- 頸部屈筋の筋力低下により、横になっている状態から起き上がる際に頭が下がる
- 頸部伸筋の筋力低下により後頸部の痛みや頭部下垂を生じる
-
- 呼吸筋
-
- 肋間筋、横隔膜の筋力低下により呼吸不全を起こす
- 呼吸補助筋の使用がみられないこともある
筋力低下が進行すると、重篤な合併症である筋無力症クリーゼ(気管挿管や人工呼吸器などが必要な呼吸不全となった状態)を発症することがあります。MG患者の約15~20%は、典型的には診断から最初の2年以内に筋無力症クリーゼを経験するとされています13,14)。
MG患者さんの治療負荷・疾病負荷
MGは、半数以上の患者さんで生活、仕事に支障がない軽微症状(minimal manifestations;MM)(⇒MGFA Postintervention Status)の状態まで改善しますが、完全寛解はまれな疾患であり、多くの場合、生涯にわたって症状が継続すると考えられています3)。
MG患者さんのなかには、不十分な症状改善や既存治療に伴う負担によりQOLが低下している方や15-21)、失業や収入減少などの社会的不利益を経験する方22)が少なからずいることが報告されています。
治療介入後の症状の改善レベル23)
国内のMG患者を対象としたJapan MG Registry study(JAMG–R)の報告によると、2021年の調査におけるMMの患者割合は58%[全身型MG(gMG):52%、眼筋型MG:77%]でした。一方、寛解を達成した患者は11%でした。
MGの既存治療とQOLへの影響
-
- コルチコステロイド
-
MG患者327例を対象とした多変量解析によると、経口コルチコステロイドの用量はQOLに悪影響を及ぼす独立因子でした15)
- 主な有害事象23,24)
-
- 短期
- 躁病、GI刺激作用、皮膚障害、MG症状の悪化 など
- 長期
- 骨粗鬆症、体重増加、皮膚萎縮、耐糖能異常、緑内障、白内障、筋障害、気分障害、感染リスク増加、高血圧、クッシング様外観 など
-
- 非ステロイド性免疫抑制療法
-
- 多くの場合、効果発現までに数ヵ月を要します25)
- 疾患活動性とは無関係に、非ステロイド性免疫抑制薬による治療はSF-36の身体的側面の複合スコアに悪影響を及ぼしました26)
- 主な有害事象27-29)
- 感染症、耐糖能異常、高血圧、腎機能障害 など※
- ※
- シクロスポリン及びタクロリムス共通の主な副作用
-
- 免疫グロブリン静注療法(IVIg)、血漿交換(PLEX)
-
- 病院で数日間にわたって行われるため30)、患者は高頻度の通院を要します
- 治療効果はIVIg及びPLEXの施行から数日以内に認められますが、臨床効果は病原性自己抗体が新たに合成されるため数週間しか持続しないとされています30)
- 主な有害事象
-
- IVIg
- 頭痛、発熱、軽症高血圧、悪寒、悪心 など31)
- PLEX
- ピリピリ感、悪寒/発熱、紅潮、悪心/嘔吐、遅発性C型肝炎、溶血、不整脈、腹痛、背部痛、クインケ浮腫、高血圧、投与部位血腫 など32)
MGが患者さんへ及ぼす精神的影響
-
- うつ発症リスク(海外データ)33)
-
MG患者は対照群と比較してうつの累積発症率が高く(p=0.003、log-rank検定)、ハザード比は1.94(95%CI:1.15~3.27、p=0.014、多変量Cox比例ハザード回帰モデル※)でした。
- ※
- 年齢、性別、併存疾患、都市化、月収で調整した
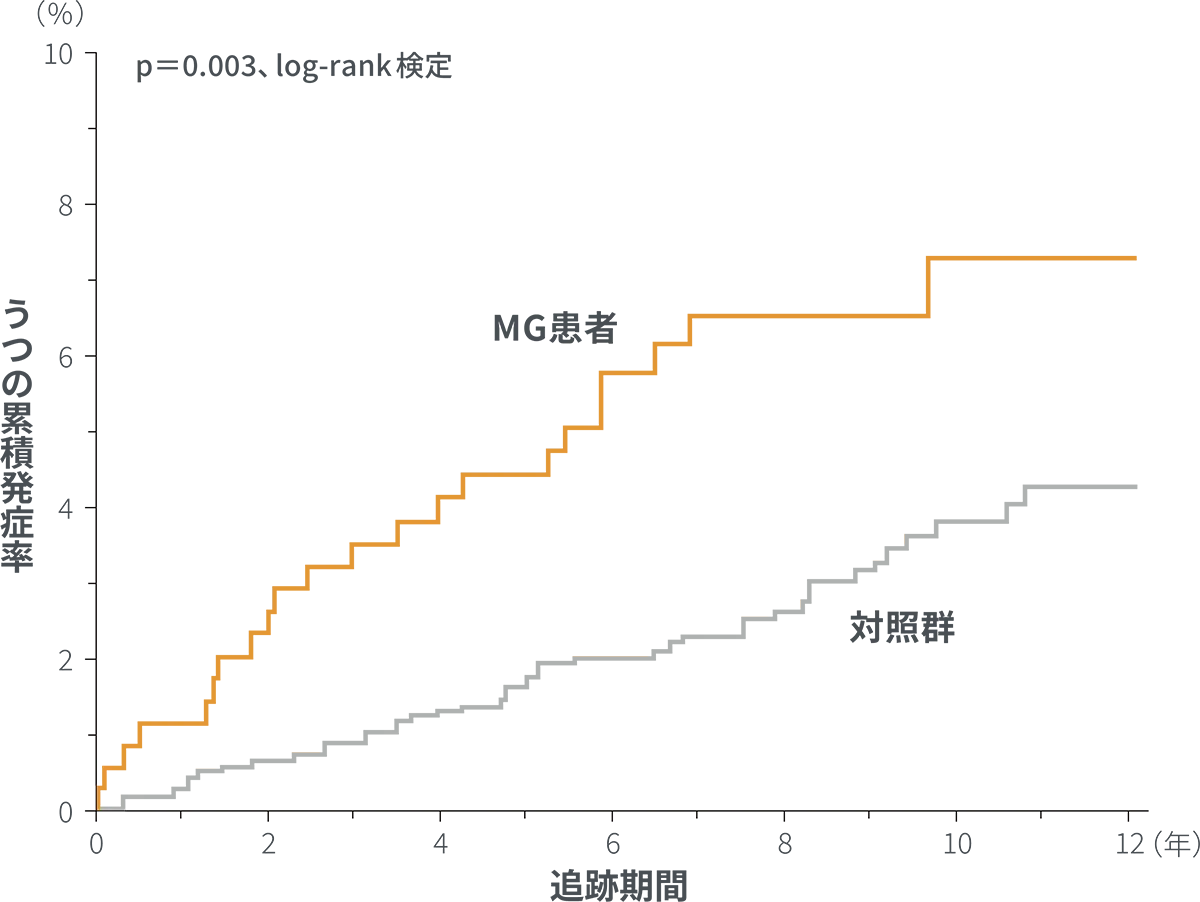
- 対象・方法
- 台湾のNational Health Insurance Research Database (NHIRD) に、2000年1月1日から2008年12月31日の間に新たにMGと診断された20歳以上のMG患者を対象とした後向きコホート研究。depressive disorder(ICD-9-CMコード:296.2X-296.3X、300.4、及び311.X)と診断されたMG患者は登録前に対象から除外された。MG及びうつに罹患していない、年齢、性別、及び登録日をマッチさせた被験者を対照群として、MG患者(n=349)と対照群(n=1,396)におけるうつの発症リスクを評価した。
Chu HT et al.: Front Psychiatry. 2019; 10: 481
(https://creativecommons.org/licenses/by/4.0/) - 不安、疲労(海外データ)
-
- MG患者の不安の有病率は33%であり、これは他の自己免疫疾患よりも高い数値であると考えられています34)。
- MG患者は、寛解または軽微症状(MM以上)の状態であっても身体的疲労及び精神的疲労を感じていました。また、疲労は抑うつおよび日中の眠気と正の相関を示しました(抑うつ:r=0.691、p=0.000、眠気:r=0.422、p=0.002、Spearmanの相関検定)35)。
MG患者さんの社会的に不利益な状況22)
就労による収入を得ているMG患者のうち、失業、不本意な配置転換、収入の減少を経験した割合はそれぞれ27.2%、4.1%、35.9%でした。さらに、収入の減少を経験した患者のうち47.1%は、50%以上の収入減少を経験していました。
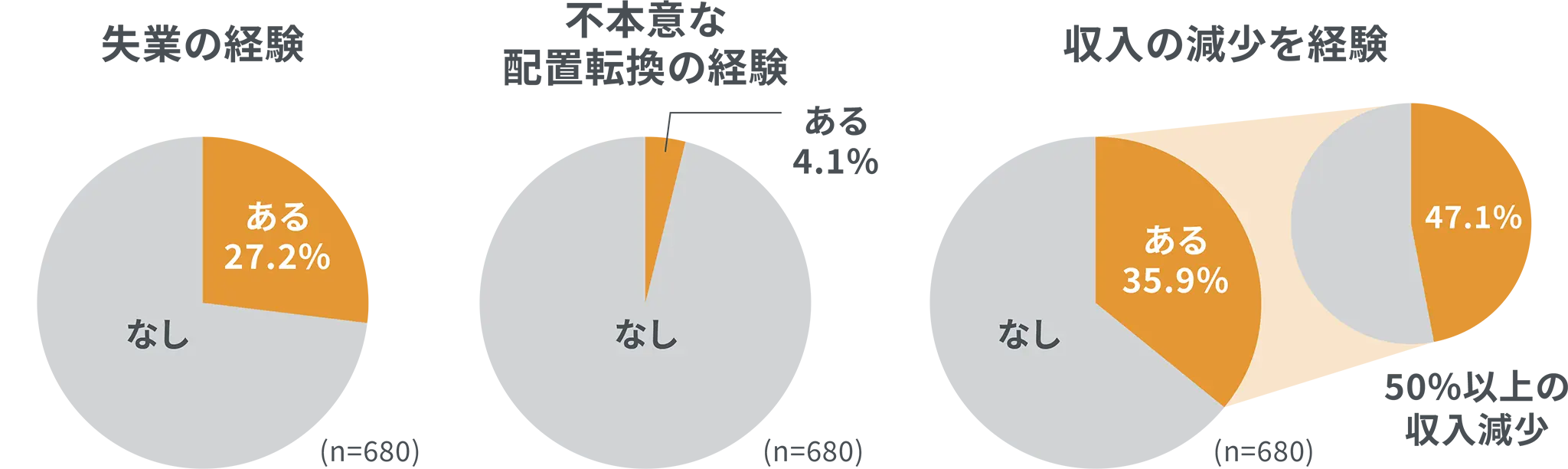
- 対象・方法
- Japan MG Registryに登録されている日本国内の13の神経医療施設を受診したMG患者917例を対象とした多施設横断的研究。 MG患者の社会的不利益の状況、社会的不利益と疾患及び治療との関連を検討することを目的とし、対象患者にアンケート調査を実施した。失業、不本意な配置転換、収入の減少を経験した割合は、就労により収入を得ている患者680例(平均年齢57.1歳)を対象に解析した。
Nagane Y, et al.: BMJ Open. 7(2): e013278より作成
重症筋無力症(MG)の治療
重症筋無力症(MG)の治療法
MGの治療は免疫療法を基本とし、補助的治療として対症療法が検討されます3)。
免疫療法として経口ステロイド、経口ステロイド以外の免疫抑制薬、ステロイドパルス療法、血漿交換(PLEX)、免疫グロブリン静注療法(IVIg)、分子標的治療薬があり、対症療法として抗コリンエステラーゼ薬などがあります。外科的治療として、胸腺異常に対して胸腺摘除が検討されます3)。
重症筋無力症(MG)の治療目標
MG治療では、患者さんのhealth-related quality of life (QOL)やメンタルヘルスを良好に保つように治療戦略を立てることが治療上の基本的な考え方として示され、治療目標として、「経口プレドニゾロン5mg/日以下でminimal manifestationsレベル(MM-5mg)」の早期達成が推奨されています3)。
- CQ 5-1-1
- 治療上の基本的な考え方は
-
- 推奨
-
- 成人発症 MG の長期完全寛解は得難い(推奨提示 1C). 治療が多くの場合,生涯にわたることを意識し,health-related quality of life(QOL)やメンタルヘルスを良好に保つように治療戦略を立てる(推奨提示 1C).
- MG 治療における最初の治療目標は,「経口プレドニゾロン5mg/日以下で minimal manifestationsレベル(MM-5mg)」であり,これを早期達成するよう治療戦略を考える(推奨提示 1C).
- MM-5mg は免疫治療開始から約 5 年間その達成が増加するが,以後,ほとんど増加しないため,なるべく早期の達成を目指す(推奨提示 1C).
- 経口ステロイドの最高用量や中等量以上の投与期間は MM-5mg 達成に関連しない.
- 早期速効性治療戦略(early fast-acting treatment strategy:EFT)はMM-5mg の早期達成に有効である(推奨提示 1B).
- 漸増漸減による高用量経口ステロイド療法は様々な副作用や QOL 阻害につながりやすく,かつ,完全寛解や早期 MM-5mg に関連しないため推奨されない(推奨提示 1B).
- 難治性 MG とは,「複数の経口免疫治療薬による治療」あるいは「経口免疫治療薬と繰り返す非経口速効性治療を併用する治療」を一定期間行っても,「十分な改善が得られない」あるいは「副作用や負担のため十分な治療の継続が困難である」場合である.
- 全身型 MG の治療ではあくまで免疫療法が中心であるが,抗コリンエステラーゼ薬は補助的薬剤として有効である(推奨提示 1C).
- MM(Minimal Manifestations)
- 軽微な筋力低下は存在するが、日常生活には支障がない状態。
「日本神経学会 監修:重症筋無力症/ランバート・イートン筋無力症候群診療ガイドライン2022, p.50, 2022, 南江堂」より許諾を得て転載.
全身型MGでは、早期速効性治療戦略(EFT)により早期改善と経口ステロイド量抑制の両立を図ります。EFTによりMM-5mgの早期達成が期待できます3)。
- CQ 5-1-2
- 早期速効性治療戦略とは何か
-
- 推奨
-
- 早期速効性治療戦略(early fast-acting treatment strategy:EFT)では,非経口速効性治療(fast-acting treatment:FT)を積極的に行い,早期改善と経口ステロイド量抑制の両立を図る(推奨提示 1C).
- 現状での非経口速効性治療とは血漿浄化療法,メチルプレドニゾロン静脈内投与療法(ステロイドパルス療法),免疫グロブリン静注療法,あるいはこれらを組み合わせた治療である.ステロイドパルス療法をうまく用いる(推奨提示 1C).
- 経口ステロイドを重視する従来型治療に比し,EFT では治療到達目標 MM-5mgの早期達成率が高い(推奨提示 1B).
- EFT における経口免疫治療では,治療初期から経口ステロイドは少量にとどめ,カルシニューリン阻害薬を併用することが望ましい(推奨提示 1C).
- 長期的に頻回の FT を要し続ける患者は難治性 MG に相当する.
「日本神経学会 監修:重症筋無力症/ランバート・イートン筋無力症候群診療ガイドライン2022, p.54, 2022, 南江堂」より許諾を得て転載.
- 推奨の強さ
-
- 1:強く推奨する(recommend)
- 行うことを推奨する/行わないことを推奨する
- 2:弱く推奨する(suggest)
- 行うことを提案する/行わないことを提案する
- エビデンスの強さ
-
- A(強い)
- 効果の推定値に強く確信がある
- B(中程度)
- 効果の推定値に中程度の確信がある
- C(弱い)
- 効果の推定値に対する確信は限定的である
- D(とても弱い)
- 効果の推定値がほとんど確信できない
「日本神経学会 監修:重症筋無力症/ランバート・イートン筋無力症候群診療ガイドライン2022, p.ⅵ,ⅶ, 2022, 南江堂」より許諾を得て転載.
重症筋無力症(MG)の治療アルゴリズム
「重症筋無力症/ランバート・イートン筋無力症候群診療ガイドライン2022」では、病型(成人重症筋無力症(MG)のサブタイプ分類)ごとに治療アルゴリズムが示されています3)。
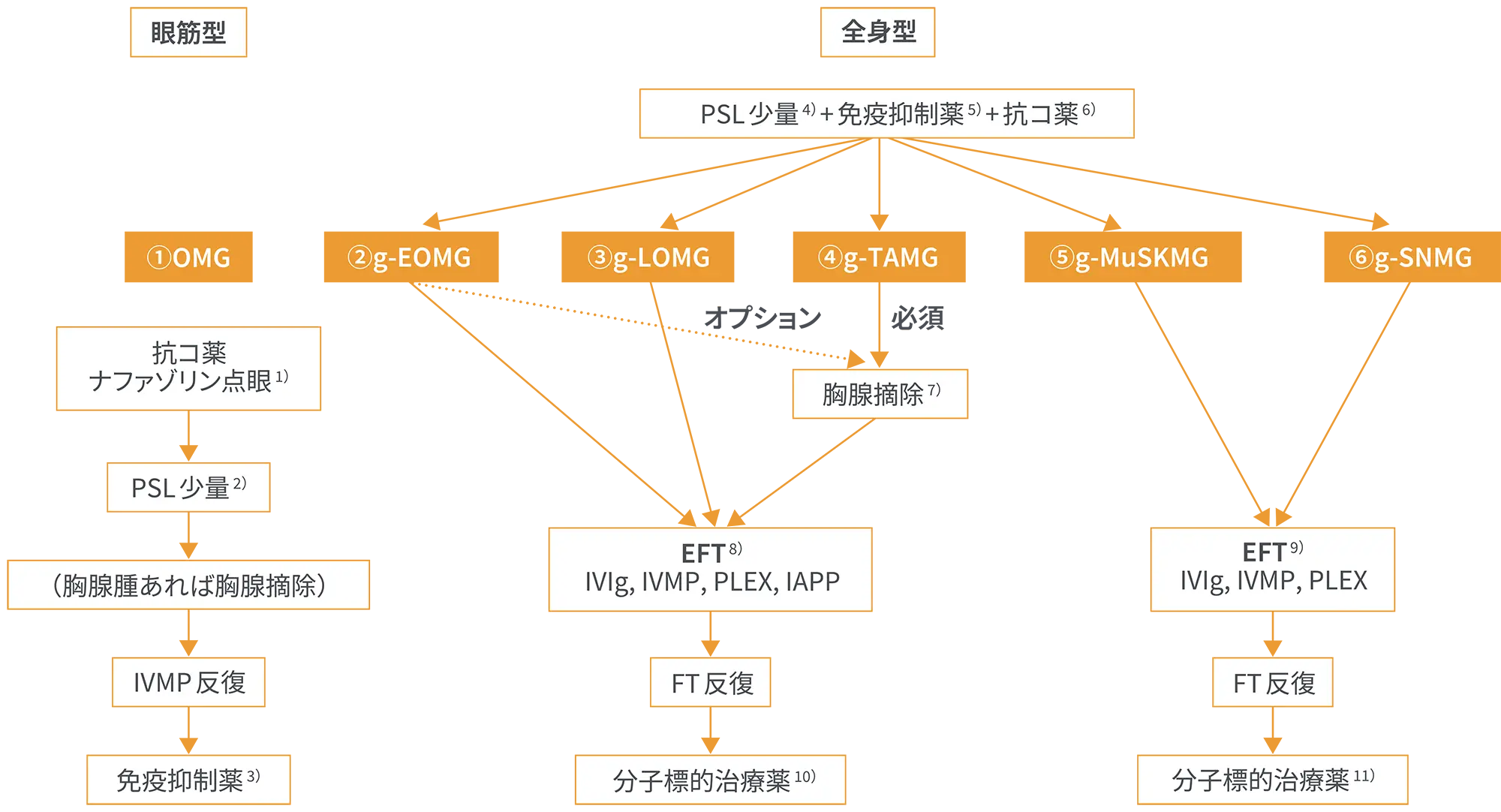
各病型(①OMG,②g-EOMG,③g-LOMG,④g-TAMG,⑤g-MuSKMG,⑥g-SNMG)についての説明はガイドラインを参照のこと.
-
- 抗コ薬
- 抗コリンエステラーゼ薬
-
- PSL
- プレドニゾロン
-
- IVMP
- メチルプレドニゾロン静脈内投与
-
- EFT
- 早期速効性治療
-
- IVIg
- 免疫グロブリン静注療法
-
- PLEX
- 血漿交換
-
- IAPP
- 免疫吸着療法
-
- FT
- 速効性治療
- 脚注
-
- 1
- ナファゾリン点眼液は表在性充血などに汎用される点眼液である。 本邦ではMGに対しての保険適用はない。眼筋型のみならず、全身型の眼瞼下垂にも有効である場合がある。あらかじめ薬剤部などで点眼用の容器に分注しておく必要がある。
- 2
- 眼筋型MGにおける経口ステロイドはプレドニゾロン5mg以下を推奨する。
- 3
- 眼筋型MGに対し保険適用になっている免疫抑制薬はタクロリムスのみである。 免疫抑制薬の投与開始時期はPSL開始の前後でもよい。
- 4
- 全身型MGにおける経口ステロイドはプレドニゾロン10mg以下にとどめることを推奨する。 多くても20mgは超えないようにする。
- 5
- 本邦ではタクロリムスとシクロスポリンのみが保険適用である。アザチオプリンは正式な保険適用を有しないが、診療報酬上、原則としてその使用は認められる。
- 6
- 抗コリンエステラーゼ薬としては通常ピリドスチグミンが使用される。 症状が改善したら漸減中止を目指す。
- 7
- 胸腺摘除を行う場合、球症状や呼吸苦などを有する症例では術後に症状の急性増悪(クリーゼを含む)をきたしやすいため、術前にEFTなど十分な免疫治療を行う必要がある。 ただし、その場合にステロイドパルス療法を単独で行うことは危険である。 非胸腺腫MGに対する胸腺摘除の適応についてはCQ5-2-1を参照のこと。
- 8
- 早期速効性治療は、少量の経口ステロイドと免疫抑制薬で効果が不十分であれば速やかに行う。IVMPはIVIg、PLEX、IAPPと組み合わせて行うことを推奨する。
- 9
- 早期速効性治療をg-MuSKMGやg-SNMGに対して行うときには、IAPPの効果がPLEXよりも劣る場合があるためIAPPを選択しないことを推奨する。
- 10
- AChR抗体陽性MG(②、③、④)でEFT/FTを行っても十分な治療効果が得られない場合には、 分子標的治療薬としてエクリズマブを用いることが可能である。
- 11
- AChR抗体陰性MG(⑤、⑥)でEFT/FTを行っても十分な治療効果が得られない場合には、分子標的治療薬としてリツキシマブなどが有効な場合がある。 特にMuSK抗体陽性MGに対するリツキシマブの有効性は海外では確立しているが、 本邦では保険適用外である。
キャプション中のCQは原典を参照すること
「日本神経学会 監修:重症筋無力症/ランバート・イートン筋無力症候群診療ガイドライン2022, p.47, 2022, 南江堂」より許諾を得て転載.
- 注
- ジルビスクⓇ及びリスティーゴⓇは分子標的治療薬に該当しますが、両薬剤は2023年9月に「全身型重症筋無力症(ステロイド剤又はステロイド剤以外の免疫抑制剤が十分に奏効しない場合に限る)」を効能又は効果として製造販売承認を取得しました。そのため、ジルビスクⓇ及びリスティーゴⓇは本ガイドラインには記載されていません。上記治療アルゴリズムにおける「分子標的治療薬」はエクリズマブとリツキシマブ(本邦では保険適用外)を指しています。
治療目標達成とQOL
Japan MG Registry study(JAMG–R)によると、国内の13施設、1,710例のMG患者を対象とした2021年の調査におけるMM-5mgの達成率は50%でした。また、同調査ではMM-5mgの達成と患者QOLの関連を評価し、MM-5mgの達成によりQOLの改善が期待できることも示されました6)。
<文献>
- 1
- Juel VC et al.: Orphanet J Rare Dis 2007; 2: 44.
- 2
- Phillips WD et al.: F1000Res 2016; 5: F1000 Faculty Rev-1513
- 3
- 日本神経学会 監修:重症筋無力症/ランバート・イートン筋無力症候群診療ガイドライン2022, p.2-4,14,15, 38-43, 46,47, 50-56, 南江堂, 2022
- 4
- Higuchi O et al.: Ann Neurol 2011; 69(2): 418-422.
- 5
- Rodríguez Cruz PM et al.: JAMA Neurol 2015; 72(6): 642-649
- 6
- Suzuki S et al.: Clin Exp Neuroimmunol. 2023; 14: 5–12
- 7
- Yoshikawa H et al: PLoS One. 2022; 17(9): e0274161
- 8
- 難病情報センター:特定医療費(指定難病)受給者証所持者数 難病情報センター:特定医療費(指定難病)受給者証所持者数 https://www.nanbyou.or.jp/wp-content/uploads/2023/02/koufu20221.pdf(2023年8月閲覧)
- 9
- Murai H et al.: J Neurol Sci 2011; 305(1-2): 97-102
- 10
- Thanvi Br et al.: Postgrad Med J 2003; 80(950): 690-700
- 11
- Melzer N, et al.: J Neurol 2016; 263(8): 1473-1494
- 12
- Burakgazi, et al.: Neurol Int 2019; 11(3): 8198
- 13
- Wendell LC, Levine JM.: Neurohospitalist 2011; 1(1): 16-22
- 14
- Murthy JMK.: Ann Indian Acad Neurol 2019; 22(4): 472-473
- 15
- Masuda M et al.: Muscle Nerve 2012; 46: 166-173
- 16
- Utsugisawa K et al.: Muscle Nerve 2014; 50: 493-500
- 17
- Utsugisawa K et al.: Muscle Nerve 2017; 55: 794-801
- 18
- Suzuki Y et al.: BMJ Open 2011; 1: e000313
- 19
- Murai H et al.: Ann N Y Acad Sci 2018; 1413: 35-40
- 20
- Konno S et al.: PLoS One 2015; 10: e0126579
- 21
- Twork S et al.: Health Qual Life Outcomes 2010; 8: 129-138
- 22
- Nagane Y, et al.: BMJ Open 2017; 7(2): e013278
- 23
- Gilhus NE et al.: Nat Rev Dis Primers 2019; 5: 30
- 24
- Schneider-Gold C et al.: Ther Adv Neurol Disord 2019; 12: 1–16
- 25
- Sieb JP: Clin Exp Immunol. 2014; 175: 408–418
- 26
- Boldingh MI, et al.: Health Qual Life Outcomes 2015; 13: 115
- 27
- Farmakidis C, et al.: Neurol Clin. 2018; 36: 311–337
- 28
- Gilhus NE: N Engl J Med. 2016; 375: 2570–2581
- 29
- Barbarino JM et al.: Pharmacogenet Genomics. 2013; 23(10):563-585
- 30
- Wendell LC et al.: Neurohospitalist 2011; 1:16–22
- 31
- Patwa HS et al.: Neurology 2012; 78: 1009-1015
- 32
- Mörtzell Henriksson M, et al.: Transfus Apher Sci 2016; 54: 2–15
- 33
- Chu HT et al.: Front Psychiatry. 2019; 10: 481
- 34
- Nadali J, et al.: Brain Behav. 2023; 13(1): e2840
- 35
- Akkan Suzan A, et al.: Acta Neurol Belg. 2022; 122: 915-923


