ご利用にあたってのご注意
このQ&Aに記載の情報は、製品の適正使用にあたっての参考情報であり、すべての患者さん/事例にあてはまるものではありません。
そのため、Q&Aの利用に関して生じた結果については、責任を負いかねますので、ご了承ください。
また、国内で承認されていない効能又は効果/用法及び用量等の情報を含む場合がありますが、弊社としてこれらの使用を推奨するものではありません。
製品のご使用にあたっては、最新の電子化された添付文書をご確認ください。
製品に関してご不明な点がございましたら、弊社ユーシービーケアーズ コンタクトセンター(0120-093-189)にお問い合わせください。なお、本Q&Aを
許可なく複写、複製、転掲、改変、配布等を行うことは固くお断りします。
TNFα阻害薬
シムジア®
- シムジア®
皮下注200mgオートクリックス® - シムジア®
皮下注200mgシリンジ
効能又は効果
〇関節リウマチ(関節の構造的損傷の防止を含む)
〇既存治療で効果不十分な下記疾患
尋常性乾癬、乾癬性関節炎、膿疱性乾癬、乾癬性紅皮症
なお、本剤の電子添文(電子化された添付文書)の「5. 効能又は効果に関連する注意」に次の記載があります。
〈関節リウマチ〉
5.1 本剤の適用は、原則として既存治療で効果不十分な関節リウマチ患者に限定すること。ただし、関節の構造的損傷の進展リスクが高いと推測される患者に対しては、抗リウマチ薬による治療歴がない場合でも使用できるが、最新のガイドライン等を参照した上で、患者の状態を評価し、本剤の使用の必要性を慎重に判断すること。
〈尋常性乾癬、乾癬性関節炎、膿疱性乾癬、乾癬性紅皮症〉
5.2 以下のいずれかを満たす患者に投与すること。
・ 光線療法を含む既存の全身療法(生物製剤を除く)で十分な効果が得られず、皮疹が体表面積の10%以上に及ぶ患者。
・ 難治性の皮疹、関節症状又は膿疱を有する患者。
2025年4月作成
MED-JP-CZP-2500001
用法及び用量
〈関節リウマチ〉
通常、成人にはセルトリズマブ ペゴル(遺伝子組換え)として、1回400mgを初回、2週後、4週後に皮下注射し、以後1回200mgを2週間の間隔で皮下注射する。
なお、症状安定後には、1回400mgを4週間の間隔で皮下注射できる。
〈尋常性乾癬、乾癬性関節炎、膿疱性乾癬、乾癬性紅皮症〉
通常、成人にはセルトリズマブ ペゴル(遺伝子組換え)として、1回400mgを2週間の間隔で皮下注射する。症状安定後には、1回200mgを2週間の間隔、又は1回400mgを4週間の間隔で皮下注射できる。
なお、本剤の電子添文(電子化された添付文書)の「7.用法及び用量に関連する注意」に次の記載があります。
〈効能共通〉
7.1 本剤と他の生物製剤の併用について安全性及び有効性は確立していないので併用を避けること。
〈関節リウマチ〉
7.2 本剤による治療反応は、通常投与開始から12週以内に得られる。12週以内に治療反応が得られない場合は現在の治療計画の継続を慎重に再考すること。
7.3 関節の構造的損傷の進展リスクが高いと推測される、抗リウマチ薬による治療歴がない患者に対して本剤を使用する場合には、メトトレキサートを併用することが望ましい。
7.4 本剤とアバタセプト(遺伝子組換え)の併用は行わないこと。海外で実施したプラセボを対照とした臨床試験において、抗TNF製剤とアバタセプト(遺伝子組換え)の併用療法を受けた患者では併用による効果の増強は示されておらず、感染症及び重篤な感染症の発現率が抗TNF製剤のみによる治療を受けた患者での発現率と比べて高かった。
〈尋常性乾癬、乾癬性関節炎、膿疱性乾癬、乾癬性紅皮症〉
7.5 本剤による治療反応は、通常投与開始から16週以内に得られる。16週以内に治療反応が得られない場合は本剤の治療計画の継続を慎重に再考すること。
2025年4月作成
MED-JP-CZP-2500001
本剤の電子添文(電子化された添付文書)に次の記載があります。
18.1 作用機序
セルトリズマブ ペゴルは、ヒトTNFαに対して高い結合親和性を示しその生物活性を選択的に中和するとともに単球からの炎症性サイトカインの産生を抑制する。
2025年4月作成
MED-JP-CZP-2500001
本剤の電子添文(電子化された添付文書)に次の記載があります。
1.警告
〈効能共通〉
1.1 本剤投与により、結核、肺炎、敗血症を含む重篤な感染症及び脱髄疾患の新たな発生もしくは悪化等が報告されており、本剤との関連性は明らかではないが、悪性腫瘍の発現も報告されている。本剤が疾病を完治させる薬剤でないことも含め、これらの情報を患者に十分説明し、患者が理解したことを確認した上で、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。また、本剤の投与において、重篤な副作用により、致命的な経過をたどることがあるので、緊急時の対応が十分可能な医療施設において医師の管理指導のもとで使用し、本剤投与後に副作用が発現した場合には、主治医に連絡するよう患者に注意を与えること。
1.2 感染症
1.2.1 重篤な感染症
敗血症、肺炎、真菌感染症を含む日和見感染症等の致死的な感染症が報告されているため、十分な観察を行うなど感染症の発症に注意すること。
1.2.2 結核
播種性結核(粟粒結核)及び肺外結核(胸膜、リンパ節等)を含む結核が発症し、致命的な例も報告されている。本剤投与に先立って結核に関する十分な問診及び胸部X線検査に加え、インターフェロン-γ遊離試験又はツベルクリン反応検査を行い、適宜胸部CT検査等を行うことにより、結核感染の有無を確認すること。
結核の既往歴を有する患者及び結核の感染が疑われる患者には、結核等の感染症について診療経験を有する医師と連携の下、原則として本剤の投与開始前に適切な抗結核薬を投与すること。ツベルクリン反応等の検査が陰性の患者において、投与後に活動性結核が認められた例も報告されている。
1.3 脱髄疾患(多発性硬化症等)の臨床症状・画像診断上の新たな発生もしくは悪化が、本剤を含む抗TNF製剤でみられたとの報告がある。脱髄疾患(多発性硬化症等)及びその既往歴のある患者には投与しないこととし、脱髄疾患を疑う患者や家族歴を有する患者に投与する場合には、適宜画像診断等の検査を実施するなど、十分な観察を行うこと。
〈関節リウマチ〉
1.4 本剤の治療を行う前に、少なくとも1剤の抗リウマチ薬等の使用を十分勘案すること。また、本剤についての十分な知識と関節リウマチ治療の経験をもつ医師が使用すること。
〈尋常性乾癬、乾癬性関節炎、膿疱性乾癬、乾癬性紅皮症〉
1.5 本剤の治療を行う前に、光線療法を含む既存の全身療法(生物製剤を除く)の適用を十分に勘案すること。また、本剤についての十分な知識と乾癬の治療に十分な知識・経験をもつ医師が使用すること。
2025年4月作成
MED-JP-CZP-2500001
本剤の電子添文(電子化された添付文書)に次の記載があります。
2.禁忌(次の患者には投与しないこと)
2.1 重篤な感染症(敗血症等)の患者[症状を悪化させるおそれがある。]
2.2 活動性結核の患者[症状を悪化させるおそれがある。]
2.3 本剤の成分に対し過敏症の既往歴のある患者
2.4 脱髄疾患(多発性硬化症等)及びその既往歴のある患者[症状の再燃及び悪化のおそれがある。]
2.5 うっ血性心不全の患者
2025年4月作成
MED-JP-CZP-2500001
〇 生ワクチンについて:本剤の電子添文(電子化された添付文書)に次の記載があります。
8.5 本剤投与において、生ワクチンの接種に起因する感染症を発現したとの報告はないが、感染症発現のリスクを否定できないので、生ワクチン接種は行わないこと。
〇 生ワクチン以外のワクチンについて:本剤の電子添文に生ワクチン以外のワクチン接種に関する記載はありません。
2025年4月作成
MED-JP-CZP-2500001
本剤の電子添文(電子化された添付文書)に次の記載があります。
11.副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1 重大な副作用
11.1.1 重篤な感染症
敗血症(頻度不明)、肺炎(1.4%)等の重篤な感染症[細菌、真菌(ニューモシスティス等)、寄生虫、ウイルス等の日和見感染症によるもの]があらわれることがある。なお、感染症により死亡に至った症例が報告されている。投与中に重篤な感染症が発現した場合は、感染症がコントロールできるようになるまでは投与を中止すること。
11.1.2 結核(頻度不明)
結核[肺外結核(胸膜、リンパ節等)、播種性結核を含む]があらわれることがある。ツベルクリン反応等の検査が陰性の患者において、投与後に活動性結核があらわれることもある。また、肺外結核(胸膜、リンパ節等)もあらわれることがあることから、その可能性も十分考慮した観察を行うこと。
11.1.3 重篤なアレルギー反応(頻度不明)
アナフィラキシー等の重篤なアレルギー反応があらわれることがある。
11.1.4 脱髄疾患(頻度不明)
脱髄疾患(多発性硬化症、視神経炎、横断性脊髄炎、ギラン・バレー症候群等)の新たな発生もしくは悪化があらわれることがある。
11.1.5 重篤な血液障害(頻度不明)
再生不良性貧血を含む汎血球減少症、血球減少症(血小板減少、白血球減少、顆粒球減少等)があらわれることがある。
11.1.6 抗dsDNA抗体の陽性化を伴うループス様症候群(頻度不明)
抗dsDNA抗体が陽性化し、関節痛、筋肉痛、皮疹等の症状があらわれた場合には、投与を中止すること。
11.1.7 間質性肺炎(0.8%)
発熱、咳嗽、呼吸困難等の呼吸器症状に十分に注意し、異常が認められた場合には、速やかに胸部X線検査、胸部CT検査及び血液ガス検査等を実施し、本剤の投与を中止するとともにニューモシスティス肺炎との鑑別診断(β-Dグルカンの測定等)を考慮に入れ適切な処置を行うこと。
その他の副作用については、電子添文「11.2 その他の副作用」の項をご参照ください。
2025年4月作成
MED-JP-CZP-2500001
シムジアによる注射部位反応の副作用は、1~5%未満の頻度で報告されています。
2025年4月作成
MED-JP-CZP-2500001
本剤の電子添文(電子化された添付文書)の「9.特定の背景を有する患者に関する注意」に、腎機能障害患者への投与についての記載はありません。
2025年4月作成
MED-JP-CZP-2500001
本剤の電子添文(電子化された添付文書)の「9.特定の背景を有する患者に関する注意」に、肝機能障害患者への投与についての記載はありません。
2025年4月作成
MED-JP-CZP-2500001
本剤の電子添文(電子化された添付文書)に次の記載があります。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
妊娠中に本剤を投与した患者において、臍帯血及び出生児血中への移行が認められた。
2025年4月作成
MED-JP-CZP-2500001
本剤の電子添文(電子化された添付文書)に次の記載があります。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。本剤のヒト乳汁への移行が報告されている。
2025年4月作成
MED-JP-CZP-2500001
本剤は小児への適応はありません。
本剤の電子添文(電子化された添付文書)に次の記載があります。
9.7 小児等
小児等を対象とした国内臨床試験は実施していない。
2025年4月作成
MED-JP-CZP-2500001
本剤の電子添文(電子化された添付文書)に次の記載があります。
9.8 高齢者
感染症等の副作用の発現に留意し、十分な観察を行うこと。
一般に生理機能(免疫機能等)が低下している。
2025年4月作成
MED-JP-CZP-2500001
本剤の貯法は「2~8℃で保存」です。外箱に入れたまま冷蔵庫で保管してください。
本剤の電子添文(電子化された添付文書)に保管について次の記載があります。
貯法: 2~8℃で保存
20.取扱い上の注意
外箱開封後は遮光して保存すること。
2025年4月作成
MED-JP-CZP-2500001
本剤の電子添文(電子化された添付文書)に次の記載があります。
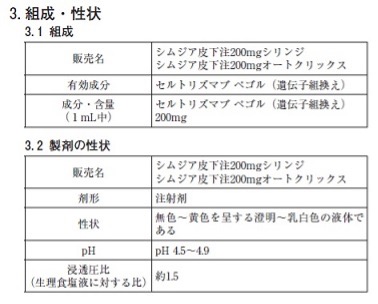
なお、本剤1mL中(シリンジまたはオートクリックス1本)に下記の添加剤を含有します。
酢酸ナトリウム水和物 1.36mg
塩化ナトリウム 7.31mg
2025年4月作成
MED-JP-CZP-2500001
本剤の電子添文(電子化された添付文書)に投与部位について次の記載があります。
14.2 薬剤投与時の注意
14.2.1 注射部位は上腕部、腹部又は大腿部とし、同一箇所への2 本の注射は避け、投与毎に注射部位を変えること。
14.2.2 皮膚が敏感な部位、皮膚に異常のある部位(圧痛、挫傷、発赤、硬化等の部位)、乾癬の部位には注射しないこと。
2025年4月作成
MED-JP-CZP-2500001
本剤の電子添文(電子化された添付文書)に自己投与について次の記載があります。
8.8 本剤の投与開始にあたっては、医療施設において、必ず医師によるか、医師の直接の監督のもとで投与を行うこと。自己投与の適用については、医師がその妥当性を慎重に検討し、十分な教育訓練を実施したのち、本剤投与による危険性と対処法について患者が理解し、患者自ら確実に投与できることを確認した上で、医師の管理指導のもとで実施すること。また、適用後、感染症等本剤による副作用が疑われる場合や自己投与の継続が困難な状況となる可能性がある場合には、直ちに自己投与を中止させ、医師の管理下で慎重に観察するなど適切な処置を行うこと。使用済みの注射器(注射針一体型)を再使用しないように患者に注意を促し、安全な廃棄方法に関する指導を行うこと。
2025年4月作成
MED-JP-CZP-2500001
本剤の電子添文(電子化された添付文書)に薬物動態パラメータについて次の記載があります。
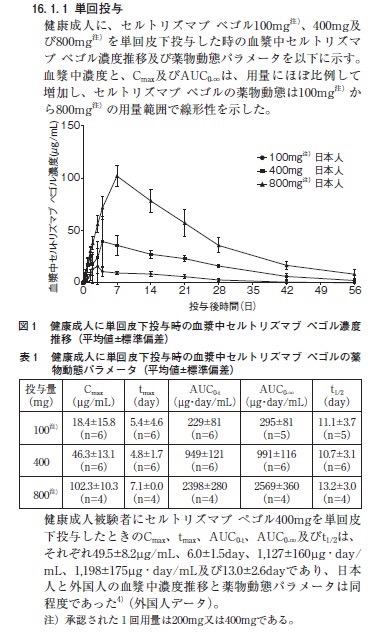
2025年4月作成
MED-JP-CZP-2500001
本剤の電子添文(電子化された添付文書)に次の記載があります。
16.4 代謝
セルトリズマブ ぺゴルのたん白質部分はペプチド及びアミノ酸に代謝されると推定される。
16.5 排泄
健康成人にセルトリズマブ ペゴル400mgを単回皮下投与した時、尿中にはセルトリズマブ ペゴルから遊離したPEGが検出され、未変化体は検出されなかった(外国人データ)。
2025年4月作成
MED-JP-CZP-2500001

