ご利用にあたってのご注意
このQ&Aに記載の情報は、製品の適正使用にあたっての参考情報であり、すべての患者さん/事例にあてはまるものではありません。
そのため、Q&Aの利用に関して生じた結果については、責任を負いかねますので、ご了承ください。
また、国内で承認されていない効能又は効果/用法及び用量等の情報を含む場合がありますが、弊社としてこれらの使用を推奨するものではありません。
製品のご使用にあたっては、最新の電子化された添付文書をご確認ください。
製品に関してご不明な点がございましたら、弊社ユーシービーケアーズ コンタクトセンター(0120-093-189)にお問い合わせください。なお、本Q&Aを
許可なく複写、複製、転掲、改変、配布等を行うことは固くお断りします。
抗FcRn モノクローナル抗体製剤
リスティーゴ®
- リスティーゴ®皮下注280mg
- リスティーゴ®皮下注420mg
電子添文に記載のとおり、1週間間隔で投与してください。
- <引用>
- リスティーゴⓇ皮下注280mg 電子添文
JP-RZ-2400008
体重の下限は設定されていません。
■リスティーゴⓇの投与量
リスティーゴⓇの承認された用量はロザノリキシズマブとして7mg/kg相当注)です。
- 注)
-
リスティーゴⓇで承認されている「用法及び用量」は以下のとおりである。
「通常、成人にはロザノリキシズマブ(遺伝子組換え)として下表に示す用量を1週間間隔で6回皮下注射する。これを1サイクルとして、投与を繰り返す。」
体重 投与量 50kg未満 280mg 50kg以上70kg未満 420mg 70kg以上100kg未満 560mg 100kg以上 840mg
本剤の国際共同第Ⅲ相試験(MG0003試験、MycarinG)では体重35kg以上の全身型重症筋無力症(gMG)患者が組み入れ対象であり、組み入れられた患者の最低体重は37.7kgでしたが、日本人成人の体重分布を踏まえると、実臨床においては、体重30kg程度の成人患者がいることも想定されることから、母集団薬物動態(PPK)/薬力学(PD)モデル(CL0534解析)に基づき、体重30kgの患者にロザノリキシズマブ280mgを投与したときの血漿中濃度をシミュレーション※1しました。その結果、定常状態時のロザノリキシズマブの曝露量の推定値(中央値[5パーセンタイル, 95パーセンタイル])は、Cmaxで22.11[2.59, 78.38]μg/mL、AUCtauで72.82[7.77, 390.89]μg·day/mLであり、MG0003試験における7mg/kg相当群又は10mg/kg相当群注)での各患者の定常状態時のCmax及びAUCtauの推定値(表27)の5~95パーセンタイルの範囲内でした。
以上を踏まえ、体重35kg未満の患者に対してロザノリキシズマブ280mgを投与することは臨床薬理学的観点から妥当であり、本剤の申請用法・用量において、体重の下限を設定しないことが妥当と考えました。
- ※1
- 体重30kgの400例の仮想集団にロザノリキシズマブ280mgを週1回6回皮下投与したときの血漿中濃度をシミュレーションした。
- 表27
- PPK/PDモデルに基づく、MG0003試験の7mg/kg相当群または10mg/kg相当群における各被験者のCmax及びAUCの推定値
| 投与量(mg) | 例数 | Cmax(μg/mL) | AUCtau(μg·day/mL) | |
|---|---|---|---|---|
| 7mg/kg 相当群 |
280 | 7 | 7.77 [4.08, 29.2] | 17.0 [9.73, 122] |
| 420 | 18 | 18.9 [8.34, 30.2] | 56.6 [17.4, 89.5] | |
| 560 | 25 | 24.2 [0.952, 43.6] | 77.7 [3.12, 159] | |
| 840 | 14 | 15.7 [3.18, 60.4] | 52.6 [9.13, 256] | |
| 10mg/kg 相当群 |
420 | 1 | 19.5a) | 56.8a) |
| 560 | 25 | 39.7 [5.23, 68.0] | 125 [13.9, 321] | |
| 840 | 24 | 47.3 [24.7, 106] | 200 [72.0, 588] | |
| 1120 | 19 | 48.9 [27.4, 71.4] | 191 [109, 335] |
中央値 [5パーセンタイル, 95パーセンタイル]
- a)
- 個別値
(参照:PMDA審査報告書 6.R.2 臨床薬理学的観点からの用法・用量の適切性について)
- 注)
-
リスティーゴⓇの承認された用量はロザノリキシズマブとして7mg/kg相当です。
リスティーゴⓇで承認されている「用法及び用量」は以下のとおりである。
「通常、成人にはロザノリキシズマブ(遺伝子組換え)として下表に示す用量を1週間間隔で6回皮下注射する。これを1サイクルとして、投与を繰り返す。」
体重 投与量 50kg未満 280mg 50kg以上70kg未満 420mg 70kg以上100kg未満 560mg 100kg以上 840mg
- <引用>
- リスティーゴⓇ皮下注280mg 電子添文
- PMDA審査報告書(令和5年8月8日)※2-6.R.2 臨床薬理学的観点からの用法・用量の適切性について
- ※2
- 審査報告書はPMDAサイトからご確認ください。
JP-RZ-2400008
本剤の投与経路は皮下投与です。ヒト初回投与試験である第Ⅰ相臨床試験(UP0018試験)で本剤を静脈投与及び皮下投与したときに認められた安全性プロファイルに基づき、その後の臨床開発プログラムでは皮下投与製剤の開発が進められました。
本剤のgMG患者を対象とした第Ⅲ相臨床試験プログラム(MG0003試験、MG0004試験、MG0007試験)では、投与及び調製を簡便にするため4つの体重カテゴリ(35kg以上50kg未満、50kg以上70kg未満、70kg以上100kg未満、100kg以上)別に固定用量で投与しました。体重カテゴリごとに規定した固定用量は、ロザノリキシズマブ7mg/kg相当又は10mg/kg注)相当とし、第Ⅰ相臨床試験(UP0018試験)、第Ⅱa相臨床試験(MG0002試験)及び一次性免疫性血小板減少症患者を対象とした第Ⅱ相臨床試験(TP0001試験)において、体重の範囲を通じて認められた、体重当たりの用量(mg/kg)による有効性及び安全性データとともに、PD[免疫グロブリンG(IgG)]に対する効果が再現されるよう選択されました。
検証的試験であるMG0003試験では、検討した本剤の2用量(ロザノリキシズマブ7mg/kg相当及び10mg/kg注)相当)ともに臨床的有効性が確認され、治験薬投与後に発現した有害事象(TEAE)の発現率は、MG0003試験では7mg/kg群で81.3%(52/64例)、10mg/kg注)群で82.6%(57/69例)でした。また、反復治療サイクル(1週間間隔で6回皮下注射)におけるTEAEの発現率は7mg/kg群で77.4%(103/133例)、10mg/kg注)群で91.6%(120/131例)でした。高度なTEAEの発現率は、MG0003試験の7mg/kg群で4.7%(3/64例)、プラセボ群で4.5%(3/67例)であり、10mg/kg注)群では18.8%(13/69例)でした。この傾向は反復治療サイクルでも認められました[7mg/kg群で9.0%(12/133例)、10mg/kg注)群で29.8%(39/131例)]。
このように、7mg/kg相当と比較して10mg/kg注)相当でベネフィットの増加は認められなかったため、最適なベネフィット・リスクの投与量は7mg/kg相当と考えられました。
以上より、本剤の用法及び用量は、体重カテゴリに基づくロザノリキシズマブ7mg/kg相当の固定用量を1回の投与量として1週間間隔で6回皮下注射し、これを1サイクルとして、投与を繰り返すこととしました。
- 注)
-
リスティーゴⓇの承認された用量はロザノリキシズマブとして7mg/kg相当です。
リスティーゴⓇで承認されている「用法及び用量」は以下のとおりである。
「通常、成人にはロザノリキシズマブ(遺伝子組換え)として下表に示す用量を1週間間隔で6回皮下注射する。これを1サイクルとして、投与を繰り返す。」
体重 投与量 50kg未満 280mg 50kg以上70kg未満 420mg 70kg以上100kg未満 560mg 100kg以上 840mg
JP-RZ-2400008
本剤はIgGの胎児性Fc受容体(FcRn)への結合阻害により、IgGのリサイクリング及びトランスサイトーシスを阻害し、血清中総IgG濃度を低下させます。
- <引用>
- リスティーゴⓇ皮下注280mg 電子添文
(詳細)
本剤の有効成分であるロザノリキシズマブは、FcRnに対する遺伝子組換えヒト化免疫グロブリン(Ig)G4Pモノクローナル抗体です。ロザノリキシズマブの構造は、鎖交換(IgGの重鎖・軽鎖対に解離が生じた後、特異性の異なるIgG4の同等の重鎖・軽鎖対と再会合すること)の発生を低減するため、IgG4重鎖配列の225番目のセリンをプロリンに変異させ、ヒンジ領域を改変しています。また、アルブミンとFcRnとの結合を阻害せずにIgGとFcRnとの結合を特異的に阻害するようにデザインされています。
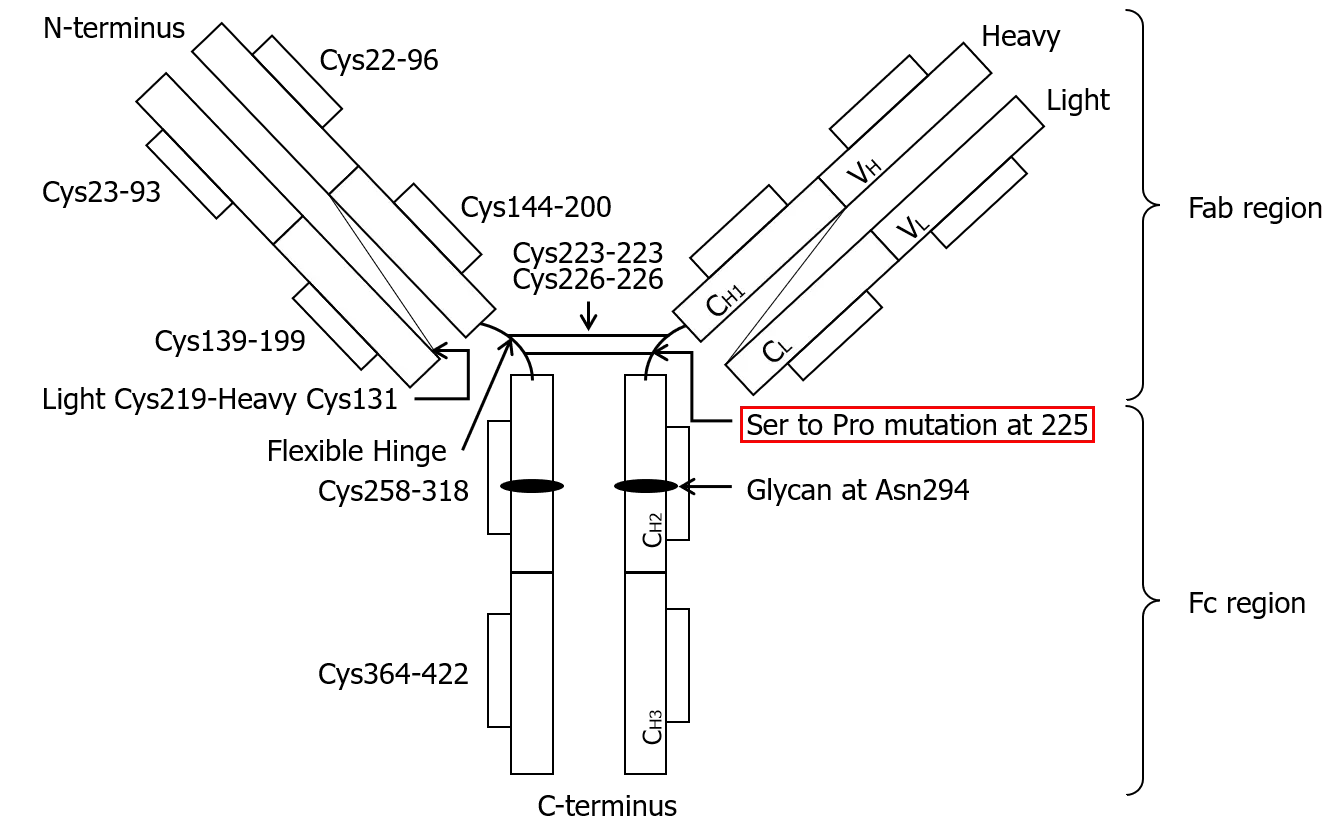
CH=重鎖定常領域、CL=軽鎖定常領域、Fab=抗原結合フラグメント、Fc=結晶性フラグメント、VH=重鎖可変領域、VL=軽鎖可変領域
ロザノリキシズマブは、FcRnとの結合部位でIgGとFcRnとの結合を競合的に阻害することにより、IgGのリサイクリング及びトランスサイトーシスを阻害し、血清中総IgG濃度を低下させます。
この機序により、gMGに伴う病原性IgG自己抗体の濃度を低下させます。
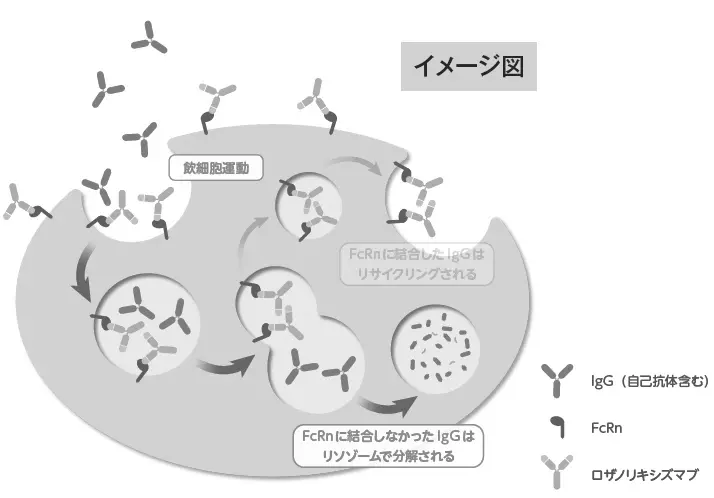
ロザノリキシズマブは中性及び酸性pH両方の条件下でFcRnに高い親和性で結合します。恒常的に細胞内へ飲細胞運動により取り込まれるIgGはエンドソーム内の酸性pH下でもFcRnへ結合できないため、リサイクルされずにリソゾームに運ばれ分解されます。
JP-RZ-2400008
本剤の主な副作用として、頭痛(頭痛、片頭痛)(36.7%)、下痢(20.7%)、発熱(12.8%)等が報告されています。
なお、頭痛、発熱は薬剤性無菌性髄膜炎の臨床症状でもあります。本剤投与中は、観察を十分に行い、薬剤性無菌性髄膜炎の臨床症状(頭痛、発熱、頚部硬直、吐き気、嘔吐等)及び徴候に注意し、異常が認められた場合には投与を中止する等、適切な処置を行ってください。
- <引用>
- リスティーゴⓇ皮下注280mg 電子添文
① 発現機序
頭痛、下痢、発熱の発現機序は不明です。
② 臨床試験
■国際共同第Ⅲ相試験(MG0003試験、MycarinG)
ロザノリキシズマブ7mg/kg相当群では頭痛32.8%(21/64例)、下痢18.8%(12/64例)、発熱7.8%(5/64例)、10mg/kg注)相当群では頭痛31.9%(22/69例)、発熱13.0%(9/69例)、下痢、悪心が各10.1%(7/69例)でした。
- 注)
-
リスティーゴⓇの承認された用量はロザノリキシズマブとして7mg/kg相当です。
リスティーゴⓇで承認されている「用法及び用量」は以下のとおりである。
「通常、成人にはロザノリキシズマブ(遺伝子組換え)として下表に示す用量を1週間間隔で6回皮下注射する。これを1サイクルとして、投与を繰り返す。」
体重 投与量 50kg未満 280mg 50kg以上70kg未満 420mg 70kg以上100kg未満 560mg 100kg以上 840mg
- <引用>
- リスティーゴⓇ皮下注280mg 電子添文
■国際共同長期継続投与試験(MG0007試験)
ロザノリキシズマブ7mg/kg相当群では頭痛19.4%(19/98例)、下痢11.2%(11/98例)、発熱3.1%(3/98例)、10mg/kg注)相当群では頭痛31.3%(30/96例)、下痢17.7%(17/96例)、発熱10.4%(10/96例)でした。
- 注)
-
リスティーゴⓇの承認された用量はロザノリキシズマブとして7mg/kg相当です。
リスティーゴⓇで承認されている「用法及び用量」は以下のとおりである。
「通常、成人にはロザノリキシズマブ(遺伝子組換え)として下表に示す用量を1週間間隔で6回皮下注射する。これを1サイクルとして、投与を繰り返す。」
体重 投与量 50kg未満 280mg 50kg以上70kg未満 420mg 70kg以上100kg未満 560mg 100kg以上 840mg
JP-RZ-2400008
■主な選択基準
- 18歳以上の男性又は女性
-
スクリーニング時に
- 既往歴又は過去の検査結果に基づき、gMGと診断されている
- 抗アセチルコリン受容体(AChR)抗体又は抗筋特異的受容体型チロシンキナーゼ(MuSK)抗体陽性が既に確認されている
- 米国重症筋無力症研究財団[MGFA(Myasthenia Gravis Foundation of America)]分類のClassⅡ~Ⅳaに該当する
- 体重が35kg以上
- スクリーニング時及びベースライン時の両時点で、重症筋無力症-日常生活動作[Myasthenia Gravis-Activities of Daily Living(MG-ADL)]総スコアが3以上(眼症状以外の項目で3以上)かつ定量的重症筋無力症[Quantitative Myasthenia Gravis(QMG)]総スコアが11以上
■主な除外基準
- スクリーニング時又はベースライン時に、口腔咽頭筋若しくは呼吸筋に影響を及ぼす重度の筋力低下(MG-ADLスケールのGrade 3)又は重症筋無力症クリーゼ若しくは切迫クリーゼを有する
- 血清中総IgG濃度が5.5g/L以下
- 好中球絶対数が1500cells/mm3未満
JP-RZ-2400008
リスティーゴは、凍結を避けて、2~8℃の冷蔵庫で保存してください。外箱に入れた状態で遮光保存してください。
(引用:電子化された添付文書 貯法、 20.取扱い上の注意)
① 温度を逸脱した場合
規定の温度(2~8℃)、保存方法(遮光)から逸脱して保存した場合は使用することはできません。
- <引用>
- リスティーゴⓇ皮下注280mg 電子添文
2024年12月改訂
MED-JP-RLZ-2400003
本剤の国際共同第Ⅲ相試験(MG0003試験、MycarinG)における有効性及び安全性は、電子添文「17.1.1 国際共同第Ⅲ相試験(MG0003試験、MycarinG)」をご参照ください。
さらなる詳細については、インタビューフォーム「Ⅴ.治療に関する項目 5.臨床成績 (4)検証的試験 1)有効性検証試験 国際共同第Ⅲ相試験(MG0003試験、MycarinG)」をご参照ください。
JP-RZ-2400008
電子添文上、他剤(標的治療薬等)、PLEX、IVIgから本剤への切り替え時のウォッシュアウト期間は規定されていません。
- <引用>
- リスティーゴⓇ皮下注280mg 電子添文
JP-RZ-2400008
電子添文上、特定の背景を有する患者に関する注意の項目に、高齢者、腎機能障害患者、肝機能障害患者の規定はありません。
高齢者、腎機能障害患者、肝機能障害患者において用量調整は必要ないと考えられます。
- <引用>
- リスティーゴⓇ皮下注280mg 電子添文
JP-RZ-2400008
本剤を過量投与した場合の症状に関するデータはありません。
JP-RZ-2400008
リスティーゴは、医師の管理指導のもとで、自己投与が可能です。
自己投与の方法は、手押し(マニュアルプッシュ、手動投与)で投与、もしくはシリンジポンプを使用して投与、の2種類があります。自己投与の方法は主治医と相談してください。
自己投与の適用(条件)については、医師がその妥当性を慎重に検討し、患者に十分な教育訓練を実施した後、リスティーゴ投与による危険性と対処法について患者が理解し、患者自ら確実に投与できることを確認した上で、医師の管理指導のもとで実施することになります。また、適用後、リスティーゴによる副作用が疑われる場合や自己投与の継続が困難な状況となる可能性がある場合には、直ちに自己投与を中止し、医師の管理下で慎重に観察するなど適切な処置を行ってください。
使用済みの注射針及び注射器は再使用しないでください。医師の指示に従って、安全な廃棄方法で廃棄してください。
- <引用>
- リスティーゴⓇ皮下注280mg 電子添文
2025年3月作成
MED-JP-RLZ-2500029
