ご利用にあたってのご注意
このQ&Aに記載の情報は、製品の適正使用にあたっての参考情報であり、すべての患者さん/事例にあてはまるものではありません。
そのため、Q&Aの利用に関して生じた結果については、責任を負いかねますので、ご了承ください。
また、国内で承認されていない効能又は効果/用法及び用量等の情報を含む場合がありますが、弊社としてこれらの使用を推奨するものではありません。
製品のご使用にあたっては、最新の電子化された添付文書をご確認ください。
製品に関してご不明な点がございましたら、弊社ユーシービーケアーズ コンタクトセンター(0120-093-189)にお問い合わせください。なお、本Q&Aを
許可なく複写、複製、転掲、改変、配布等を行うことは固くお断りします。
補体(C5)阻害剤
ジルビスク®
- ジルビスク®皮下注16.6㎎シリンジ
- ジルビスク®皮下注23.0mgシリンジ
- ジルビスク®皮下注32.4mgシリンジ
髄膜炎菌感染症は致命的な経過をたどることがありますので、緊急時に十分に措置できる医療施設及び医師のもとで、あるいは髄膜炎菌感染症の診断及び治療が可能な医療施設との連携下で投与してください。
また、本剤は、全身型重症筋無力症(gMG)に十分な知識を持つ医師のもとで、治療上の有益性が危険性を上回ると判断される場合にのみ投与することができます。
JP-ZL-2400030
眼筋型重症筋無力症への使用は、適応外となります。
本剤の効能又は効果は「全身型重症筋無力症(ステロイド剤又はステロイド剤以外の免疫抑制剤が十分に奏効しない場合に限る)」です。
また、本剤を眼筋型重症筋無力症の患者に使用した報告はありません(2023年12月現在)。
JP-ZL-2400030
本剤の投与開始前には、抗AChR抗体が陽性であることを確認してください。
JP-ZL-2400030
抗AChR抗体陰性患者には投与できません。適応外となります。
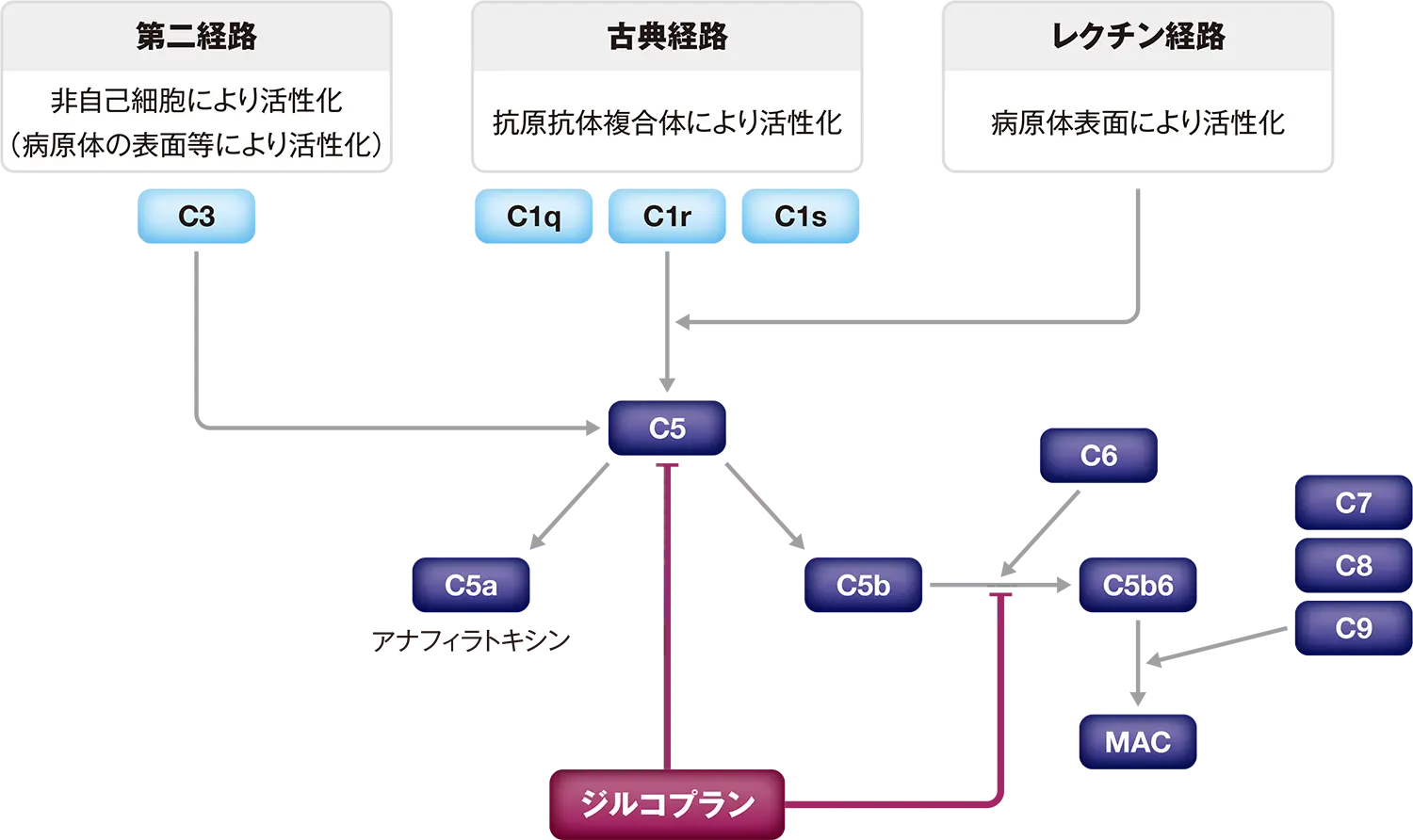
本剤は補体第5成分(C5)レベルで補体活性を阻害します。
補体カスケードは、抗AChR抗体[免疫グロブリンG(IgG)1及びIgG3 アイソタイプ]により活性化されます。抗AChR抗体陰性患者では補体カスケードが活性化されないため、ジルビスクⓇの効果は期待できません。
また、抗AChR抗体陰性のgMG患者を対象とした臨床試験は実施していません。
JP-ZL-2400030
■試験方法
本試験は第Ⅲ相、多施設共同、二重盲検、無作為化、プラセボ対照試験です。スクリーニング期間(最長4週間)及び投与期間(12週間)から構成されました。
抗AChR抗体陽性の18歳以上の重症筋無力症-日常生活動作[Myasthenia Gravis-Activities of Daily Living(MG-ADL)]総スコアが6以上、かつ定量的重症筋無力症[Quantitative Myasthenia Gravis(QMG)]総スコアが12以上であった174例(日本人患者16例を含む)を対象に、MG-ADL総スコア(9以下又は10以上)、QMG総スコア(17以下又は18以上)、地理的地域(北米、欧州及び東アジア)に基づき層別化し、ジルコプラン0.3mg/kg注)群(本剤群)又はプラセボ群のいずれかに1:1の比率で割り付け、治験薬を1日1回、反復自己注射で皮下投与しました。
なお、12週間の投与期間を通じて用量を一定とする標準治療(ステロイド剤、免疫抑制剤)が併用可能とされました。
- 注)
-
ジルビスクⓇで承認されている「用法及び用量」は以下のとおりである。
「通常、成人にはジルコプランとして下表に示す用量を1日1回皮下投与する。」
体重 投与量 56kg未満 16.6mg 56kg以上77kg未満 23.0mg 77kg以上 32.4mg
■評価項目
■解析方法
主要解析では、mITT集団を対象に Week 12におけるMG-ADL総スコアのベースラインからの変化量[最小二乗平均値(LSM)]を本剤群とプラセボ群で比較しました(両側、有意水準 0.05)。
副次評価項目の統計解析では多重性を考慮し、試験全体における第一種の過誤を制御しました(両側、有意水準 0.05)。これには、第一種の過誤を制御する2つの仮説族それぞれに対応した異なる検定手順を備えた並列型gatekeeping法を用いました。仮説族1には重要な副次評価項目を含み、固定順序法によりWeek 12におけるベースラインからの変化量をQMG総スコア、MGC総スコア、MG-QOL15r総スコアの順に検定しました。仮説族1のすべての副次評価項目が統計学的に有意(両側、第一種の過誤確率 5%)であった場合に、仮説族2(仮説族1を除くすべての副次評価項目)をHolm法(両側)で検定しました。連続変数で表される各副次評価項目(QMG、MGC及びMG-QOL15r総スコアのWeek 12におけるベースラインからの変化量)について、mITT集団を対象にANCOVA(MMRM)で解析しました。
■有効性
•主要評価項目:Week 12におけるMG-ADL総スコアのベースラインからの変化量
Week 12におけるMG-ADL総スコアのベースラインからの変化量のLSM[標準誤差(SE)]は、ジルコプラン群(本剤群)で-4.39(0.45)、プラセボ群で-2.30(0.44)でした。本剤群とプラセボ群のLSMの差は-2.09(95%CI:-3.24~-0.95、p<0.001、MMRM ANCOVA※1)であり、統計学的に有意でした。
本剤群のベースラインからの変化量のLSM(95%CI)は、Week 1で-2.65(-3.34~-1.96)、Week 4で-4.03(-4.83~-3.23)、Week 12で-4.39(-5.28~-3.50)でした。
- ※1
- 治験薬、ベースラインのMG-ADL及びQMG総スコア、地理的地域(北米、欧州及び東アジア)、治験薬と来院の交互作用項、並びにベースラインのMG-ADL総スコアと来院の交互作用項を固定効果、患者をランダム効果としたMMRM ANCOVAモデル
日本人集団における結果
Week 12におけるMG-ADL総スコアのベースラインからの変化量のLSM(SE)は、本剤群で-4.71(1.12)、プラセボ群で-0.45(0.98)でした。MMRM ANCOVAによるベースラインからWeek 12におけるMG-ADL総スコアの両群のLSMの差は-4.26(95%CI:-7.40~-1.12)でした。
本剤群のベースラインからの変化量のLSM(95%CI)は、Week 1で-2.70(-5.02~-0.37)、Week 4で-3.96(-6.29~-1.64)、Week 12で-4.71(-7.03~-2.38)であり、全体集団と同様の推移が示されました。
•重要な副次評価項目:Week 12におけるQMG総スコアのベースラインからの変化量
Week 12におけるQMG総スコアのベースラインからの変化量のLSM(SE)は、本剤群で-6.19(0.56)、プラセボ群で-3.25(0.55)でした。本剤群とプラセボ群のLSMの差は-2.94(95%CI:-4.39~-1.49、p<0.001、MMRM ANCOVA※2)でした。
本剤群のベースラインからの変化量のLSM(95%CI)は、Week 1で-3.79(-4.54~-3.03)、Week 4で-5.65(-6.67~-4.63)、Week 12で-6.19(-7.29~-5.08)であり、MG-ADL総スコアと同様の推移が示されました。
- ※2
- 治験薬、ベースラインのMG-ADL及びQMG総スコア、地理的地域(北米、欧州及び東アジア)、治験薬と来院の交互作用項、並びにベースラインのQMG総スコアと来院の交互作用項を固定効果、患者をランダム効果としたMMRM ANCOVAモデル
日本人集団における結果
Week 12におけるQMG総スコアのベースラインからの変化量の平均値(SE)は、本剤群で-4.71(1.73)及びプラセボ群で-2.56(2.01)でした。
•重要な副次評価項目:Week 12におけるMGC総スコアのベースラインからの変化量
Week 12におけるMGC総スコアのベースラインからの変化量のLSM(SE)は、本剤群で-8.62(0.81)、プラセボ群で-5.42(0.79)でした。本剤群とプラセボ群のLSMの差は-3.20 (95%CI:-5.24~-1.16、p=0.0023、MMRM ANCOVA※3)でした。
本剤群のベースラインからの変化量のLSM(95%CI)は、Week 1で-5.65(-7.02~-4.28)、Week 4で-8.07(-9.55~-6.58)、Week 12で-8.62(-10.22~-7.01)であり、MG-ADL総スコアと同様の推移が示されました。
- ※3
- 治験薬、ベースラインのMG-ADL、QMG及びMGC総スコア、地理的地域(北米、欧州及び東アジア)、治験薬と来院の交互作用項、並びにベースラインのMGC総スコアと来院の交互作用項を固定効果、患者をランダム効果としたMMRM ANCOVAモデル
日本人集団における結果
Week 12におけるMGC総スコアのベースラインからの変化量の平均値(SD)は、本剤群で-7.14(6.82)、プラセボ群で-3.44(5.36)でした。
•重要な副次評価項目:Week 12における MG-QOL15r 総スコアのベースラインからの変化量
Week 12におけるMG-QOL15r総スコアのベースラインからの変化量のLSM(SE)は、本剤群で-5.65(0.77)、プラセボ群で-3.16(0.76)でした。本剤群とプラセボ群のLSMの差は-2.49(95%CI:-4.45~-0.54、p=0.0128、MMRM ANCOVA※4)でした。
本剤群のベースラインからの変化量のLSM(95%CI)は、Week 1で-4.08(-5.30~-2.85)、Week 4で-5.69(-7.11~-4.27)、Week 12で-5.65(-7.17~-4.12)であり、MG-ADL総スコアと同様の推移が示されました。
- ※4
- 治験薬、ベースラインのMG-ADL、QMG及びMG-QOL15r総スコア、地理的地域(北米、欧州及び東アジア)、治験薬と来院の交互作用項、並びにベースラインのMG-QOL15r総スコアと来院の交互作用項を固定効果、患者をランダム効果としたMMRM ANCOVAモデル
日本人集団における結果
Week 12におけるMG-QOL15r総スコアのベースラインからの変化量の平均値[標準偏差(SD)]は、本剤群で-5.00(4.16)、プラセボ群で-1.11(6.53)でした。
•その他の副次評価項目:Week 12にMG-ADL総スコアが3点以上低下した患者の割合
レスキュー療法を受けずにWeek 12にMG-ADL総スコアが3点以上低下した患者の割合は、プラセボ群(46.1%)と比較して本剤群(73.1%)で高く、この差は統計学的に有意でした[オッズ比(95%CI):3.184(1.662~6.101)、p<0.001、ロジスティック回帰※5]。
- ※5
- 治験薬を因子、ベースラインのMG-ADL及びQMG総スコア、地理的地域を共変量とするロジスティック回帰
日本人集団における結果
日本人集団におけるレスポンダーの割合は、プラセボ群が33.3%、本剤群が85.7%でした。
•その他の副次評価項目:Week 12にQMG総スコアが5点以上低下した患者の割合
レスキュー療法を受けずにWeek 12にQMG総スコアが5点以上低下した患者の割合は、プラセボ群(33.0%)と比較して本剤群(58.0%)で高く、この差は統計学的に有意でした[オッズ比(95%CI):2.865(1.518~5.409)、p=0.0012、ロジスティック回帰※6]。
- ※6
- 治験薬を因子、ベースラインのMG-ADL及びQMG総スコア、地理的地域を共変量とするロジスティック回帰
日本人集団における結果
日本人集団におけるレスポンダーの割合は、プラセボ群が22.2%、本剤群が42.9%でした。
•その他の副次評価項目:初回のレスキュー療法までの時間
全体的に、レスキュー療法を受けた患者の割合は低かったです。初回のレスキュー療法までの時間における本剤群とプラセボ群の乖離はWeek 2(Day 15)から認められ、この乖離がWeek 12(Day 84)まで維持されました。
Week 12までにレスキュー療法を受けた患者及びその累積割合は、プラセボ群(10例、12%)と比較して本剤群(4例、5%)で数値的に低かったです(p=0.1003)。
日本人集団における結果
日本人集団でレスキュー療法を受けた患者及びその累積割合はプラセボ群で3例(33%)であり、本剤群ではレスキュー療法を受けた患者はいませんでした。
■安全性
副作用発現頻度は、本剤群で32.6%(28/86例)でした。主な副作用は、注射部位内出血11.6%(10/86例)、注射部位疼痛9.3%(8/86例)、注射部位反応、挫傷、リパーゼ増加及び頭痛各3.5%(3/86例)でした。
•治験薬と関連ありと判断されたTEAE(副作用)発現状況
すべての治験薬投与後に発現したTEAEは、プラセボ群の70.5%(62/88例)、ジルコプラン群(本剤群)の76.7%(66/86例)に認められました。副作用は、プラセボ群で25.0%(22/88例)、本剤群で32.6%(28/86例)でした。
いずれかの投与群で5%以上の患者に発現した副作用(PT別)は、注射部位内出血[プラセボ群4例(4.5%)、本剤群10例(11.6%)]、注射部位疼痛[プラセボ群3例(3.4%)、本剤群8例(9.3%)]でした。
日本人集団における、すべてのTEAEの発現割合はプラセボ群で55.6%(5/9例)、本剤群で57.1%(4/7例)でした。副作用はプラセボ群の3例(33.3%)に発現しましたが、本剤群では認められませんでした。全体集団と日本人集団で、副作用に重要な違いはありませんでした。
•死亡、重篤又は投与中止に至った副作用
死亡に至った副作用は発現しませんでした。各投与群で認められた重篤な副作用(PT別)は、本剤群で口腔カンジダ症、アフタ性潰瘍、リパーゼ増加、及び血管浮腫(各1例、1.2%)、プラセボ群で単純ヘルペス性髄膜脳炎及び髄膜転移(各1例、1.1%)でした。このうちアフタ性潰瘍(1例)は重篤で投与中止に至り、この患者はさらに非重篤なCOVID-19を発現しました。
日本人集団では、死亡、重篤又は投与中止に至った副作用は認められませんでした。
なお、インタビューフォームには、以下の症例の詳細な記載があります。必要に応じてご参照ください。
- 重篤な副作用の発現を認めた症例
- 【投与群:ジルコプラン群、重篤な有害事象(PT):アフタ性口腔潰瘍の悪化(アフタ性潰瘍)】
JP-ZL-2400030
■主な選択基準
- 1)
- 年齢が18歳以上75歳未満の男性又は女性
- 2)
- スクリーニング時にgMG[米国重症筋無力症研究財団(MGFA)の重症度基準でClass II~IV]と診断された者
- 3)
- スクリーニング時の血清中抗AChR抗体が陽性の者
- 4)
- スクリーニング時及びベースライン時のMG-ADL総スコアが6以上の者
- 5)
- 抗アセチルコリンエステラーゼ薬を10時間以上中止した状態でスクリーニング時及びベースライン時のQMG総スコアが12以上の者
- 6)
- スクリーニング時及びベースライン時の4項目以上のQMG総スコアが2以上の者
- 7)
- コルチコステロイドの用量がベースラインの30日以上前から変更されておらず、投与期間の12週間に変更予定がない者
- 8)
- 免疫抑制剤がベースラインの30日以上前から変更されておらず(用量を含む)、投与期間の12週間に変更予定がない者
2023年12月改訂
MED-JP--2300117
JP-ZL-2400030
■主要評価項目
Week 12における MG-ADL総スコアのベースラインからの変化量
■副次評価項目
- Week 12におけるQMG総スコアのベースラインからの変化量※
- Week 12におけるMyasthenia Gravis Composite(MGC)総スコアのベースラインからの変化量※
- Week 12におけるMyasthenia Gravis-Quality of Life revised(MG-QOL15r)総スコアのベースラインからの変化量※
- 安全性[治験薬と関連ありと判断された有害事象(TEAE)、注目すべきTEAE等]、免疫原性、薬物動態(PK)、薬力学(PD)
- ※
- 重要な副次評価項目
■有効性評価指標の解説
インタビューフォームの「有効性評価指標の解説」をご参照ください。
2023年12月改訂
MED-JP--2300117
JP-ZL-2400030
国際共同非盲検長期継続投与試験(MG0011試験、RAISE-XT)は、海外第Ⅱ相試験(MG0009試験)もしくは国際共同第Ⅲ相試験(MG0010試験、RAISE)を完了したgMG患者200例(日本人患者16例を含む)を対象とした非盲検継続投与試験で、本剤の長期安全性及び忍容性を評価しています。
治験薬投与後に発現したTEAEの発現頻度は全ジルコプラン群で94.0%(188/200例)でした。副作用は全ジルコプラン群の33.5%(67/200例)に発現しました。主な副作用は、注射部位内出血6.0%(12/200例)、注射部位疼痛4.5%(9/200例)、リパーゼ増加3.5%(7/200例)でした。
試験の詳細は、インタビューフォームを参照してください。
<試験概要>
■目的
先行試験(MG0009試験及びMG0010試験)を完了したgMG患者におけるジルコプランの長期安全性及び忍容性を評価する。
■試験デザイン
第Ⅲ相、多施設共同、非盲検、継続投与
[70医療機関(米国、カナダ、フランス、ドイツ、イタリア、ノルウェー、ポーランド、スペイン、英国、及び日本)]
■主な選択基準
- 主な選択基準
-
- 先行試験(MG0009試験又はMG0010試験)を完了した男性又は女性患者
■試験方法
投与量及び投与方法:本剤を下表に示す体重区分に従って各患者の体重に応じて固定量のジルコプランを含む自己投与用のプレフィルドシリンジ製剤として被験薬を供給しました。
| Minimum (nominal) target dose (mg/kg) |
Actual dose (mg) | Weight range (kg) | Dose range (mg/kg) |
|---|---|---|---|
| 0.3 | 16.6 | ≥43 to <56 | 0.30 to 0.39 |
| 0.3 | 23.0 | ≥56 to <77 | 0.30 to 0.41 |
| 0.3 | 32.4 | ≥77 to 150 | 0.22 to 0.42 |
- 試験期間:
- 本剤が承認され入手可能になるまで、又は治験依頼者がgMG治療薬としての本剤の開発を中止するまで、患者が治験依頼者から提供された本剤の投与を継続することを可能としました。
■主要評価項目
TEAEの発現割合
- その他の評価項目:
- 注目すべきTEAE、コロンビア自殺評価スケール(C-SSRS)、免疫原性、臨床検査値、バイタルサイン、12誘導心電図 等
■副次評価項目
- 本試験の Week 12(Week E12:延長12週)における MG-ADL総スコアのベースラインからの変化量
- Week E12におけるQMG総スコアのベースラインからの変化量
- Week E12におけるMGC総スコアのベースラインからの変化量
- Week E12におけるMG-QOL15r総スコアのベースラインからの変化量
- PK、PD、免疫原性
[引用:インタビューフォーム Ⅴ.治療に関する項目 5.臨床試験(4)2)①国際共同第Ⅲ相継続投与試験(MG0011試験)]
■有効性評価項目の解説
インタビューフォームの「有効性評価項目の解説」をご参照ください。
■安全性
・治験薬投与後に発現したTEAEの発現割合
全体集団:データカットオフ日までに、すべてのTEAEは全ジルコプラン群の188/200例(94.0%)、プラセボ/ジルコプラン0.3mg/kg注)(P/Z0.3)群の86/90例(95.6%)、ジルコプラン0.3mg/kg注)/ジルコプラン0.3mg/kg注)(Z0.3/Z0.3)群の85/93例(91.4%)に発現しました。
副作用は全ジルコプラン群で67例(33.5%)、P/Z0.3注)群で32例(35.6%)、Z0.3注)/Z0.3注)群で29例(31.2%)に認められました。
重篤な有害事象は全ジルコプラン群で64例(32.0%)、P/Z0.3注)群で23例(25.6%)、Z0.3注)/Z0.3注)群で34例(36.6%)、治験薬の投与中止に至ったTEAEは全ジルコプラン群で17例(8.5%)、P/Z0.3注)群で10例(11.1%)、Z0.3注)/Z0.3注)群で7例(7.5%)に発現しました。
比較的よくみられた副作用(PT別)は注射部位内出血[全ジルコプラン群:12例(6.0%)、P/Z0.3注)群7例(7.8%)、Z0.3注)/Z0.3注)群2例(2.2%)]、注射部位疼痛[全ジルコプラン群:9例(4.5%)、P/Z0.3注)群4例(4.4%)、Z0.3注)/Z0.3注)群4例(4.3%)]、リパーゼ増加[全ジルコプラン群:7例(3.5%)、P/Z0.3注)群2例(2.2%)、Z0.3注)/Z0.3注)群5例(5.4%)]等でした。
日本人集団:すべてのTEAEは、全ジルコプラン群で15例(93.8%)、Z0.3注)/Z0.3注)群で6例(85.7%)、P/Z0.3注)群で9例(100%)、副作用は全ジルコプラン群で4例(25.0%)、Z0.3注)/Z0.3注)群で1例2件(14.3%、口腔ヘルペス及び湿疹が各1件)、P/Z0.3注)群で3例3件(33.3%、注射部位内出血、帯状疱疹、及び腎機能障害が各1件)発現しました。
- 注)
-
ジルビスクⓇで承認されている「用法及び用量」は以下のとおりである。
「通常、成人にはジルコプランとして下表に示す用量を1日1回皮下投与する。」
体重 投与量 56kg未満 16.6mg 56kg以上77kg未満 23.0mg 77kg以上 32.4mg
■有効性
・副次評価項目:Week E12及びE48におけるMG-ADL総スコアの先行試験のベースラインからの変化量
MG-ADL総スコアの先行試験のベースラインからの変化量のLSMは、Z0.3注)/Z0.3注)群のWeek 12で-4.30(95% CI:-5.36~-3.25)、Week E12で-5.77(95% CI:-6.83~-4.71)、P/Z0.3注)群ではそれぞれ-2.61(95%CI:-3.95~-1.27)、-6.67(95%CI:-8.37~-4.97)でした。Week 12に対する Week E12のMG-ADL総スコアの先行試験のベースラインからの変化量のLSMの差は、Z0.3注)/Z0.3注)群で-1.47(95%CI:-2.56~-0.38、p=0.0083、MMRM ANCOVA※)、P/Z0.3注)群で-4.06(95%CI:-6.46~-1.66、p=0.0011、MMRM ANCOVA※)であり、有意に改善しました。
Z0.3注)/Z0.3注)群及びP/Z0.3注)群のいずれにおいても、MG-ADL総スコアの先行試験のベースラインからの変化量の平均値(SD)は、Week E12[Z0.3注)/Z0.3注)群:-6.25(3.70)、P/Z0.3注)群:-6.26(4.02)]からWeek E48[Z0.3注)/Z0.3注)群:-5.95(4.14)、P/Z0.3注)群:-6.85(5.13)]まで維持されました。
- ※
- ベースラインのMG-ADL及びQMG総スコア、地理的地域(北米、欧州及び日本)、先行試験、並びにMG-ADL総スコアと来院の交互作用項を固定効果、患者をランダム効果としたMMRM ANCOVAモデル
- 注)
-
ジルビスクⓇで承認されている「用法及び用量」は以下のとおりである。
「通常、成人にはジルコプランとして下表に示す用量を1日1回皮下投与する。」
体重 投与量 56kg未満 16.6mg 56kg以上77kg未満 23.0mg 77kg以上 32.4mg
JP-ZL-2400030
本剤の投与により、髄膜炎菌感染症を発症しやすくなる可能性があります。髄膜炎菌感染症の既往のある患者へ投与する場合は、患者の状態に十分注意してください。
本剤の投与に際しては髄膜炎菌感染症の初期徴候(発熱、頭痛、項部硬直等)に注意して観察を十分に行い、髄膜炎菌感染症が疑われる場合及び否定できない場合には、直ちに診察し、抗菌薬の投与、本剤の投与中止等の適切な処置を、髄膜炎菌感染症が否定できるまで行ってください。
- <引用>
- ジルビスクⓇ適正使用ガイド
JP-ZL-2400030
電子添文上、特定の背景を有する患者に関する注意の項に、腎機能障害患者の規定はありません。特別な注意喚起は行っておりません。
■腎機能障害患者を対象とした試験(UP0114試験:外国人データ)
重度腎機能障害患者(CLcrが30mL/分未満と定義)及び腎機能正常患者(各8例計16例)を対象に、ジルコプラン0.3mg/kg注)を単回皮下投与したときの薬物動態を評価する第I相、非盲検試験において、本剤投与後、重度腎機能障害患者群及び腎機能正常患者群ともにTEAEの発現は認められませんでした。また、その他の安全性評価項目(臨床検査値、バイタルサイン、12誘導心電図、身体所見)にも臨床的に重要な変動は認められませんでした。重度腎機能障害患者及び腎機能正常患者にジルコプラン0.3mg/kg注)を単回皮下投与したときの安全性が確認されました。
- 注)
-
ジルビスクⓇで承認されている「用法及び用量」は以下のとおりである。
「通常、成人にはジルコプランとして下表に示す用量を1日1回皮下投与する。」
体重 投与量 56kg未満 16.6mg 56kg以上77kg未満 23.0mg 77kg以上 32.4mg
JP-ZL-2400030
電子添文上、特定の背景を有する患者に関する注意の項に、肝機能障害患者の記載はありません。特別な注意喚起は行っておりません。
■肝機能障害患者を対象とした試験(UP0094試験:外国人データ)
中等度の肝機能障害[Child-Pugh 分類で中等度(7~9点)]患者及び肝機能正常患者(各8例計16例)を対象に、ジルコプラン0.3mg/kg注)を単回皮下投与したときの薬物動態を評価する第I相、単施設、非盲検試験において、全体で3例(18.8%)の患者に5件の治験薬投与後に発現したTEAEが認められ、このうち中等度肝機能障害患者群が2例(25.0%)4件、肝機能正常患者群が1例(12.5%)1件でした。試験期間中に、重篤な有害事象(SAE)、高度のTEAE、試験中止に至ったTEAE及び死亡は認められませんでした。
中等度肝機能障害患者群の1例に副作用として悪心が発現しました。当該事象の重症度は軽度、発現期間は20日間で転帰は消失でした。肝機能正常患者群では、副作用は認められませんでした。また、その他の安全性評価項目(臨床検査値、バイタルサイン、12誘導心電図、身体所見)にも臨床的に重要な変動は認められませんでした。本試験の結果から、新たな安全性の所見及び中等度肝機能障害患者群と肝機能正常患者群間の安全性プロファイルに違いは認められませんでした。
- 注)
-
ジルビスクⓇで承認されている「用法及び用量」は以下のとおりである。
「通常、成人にはジルコプランとして下表に示す用量を1日1回皮下投与する。」
体重 投与量 56kg未満 16.6mg 56kg以上77kg未満 23.0mg 77kg以上 32.4mg
JP-ZL-2400030
電子添文上、特定の背景を有する患者に関する注意の項に、生殖能を有する者の記載はありません。
なお、gMG患者にジルコプランを投与した場合の妊孕性、生殖能について検討した試験は実施しておりません。
■生殖発生毒性試験
ジルコプランを投与量1、2及び4mg/kg/日で妊娠中のカニクイザルに1日1回皮下投与したとき、母動物、胚・胎児発生期(妊娠20~100日)、並びに出生前及び出生後の発達時期(妊娠20日から出産を経て授乳/出生後90日まで)に毒性は誘発されませんでした。出生児の成長と発達に悪影響はなく、あるいは形態学的所見に毒性学的懸念はありませんでした。
JP-ZL-2400030
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与してください。妊婦に対する安全性は確立されていません。妊婦へのジルビスクⓇ投与に関するデータはありません。
■生殖発生毒性試験
ジルコプランを投与量1、2及び4mg/kg/日で妊娠中のカニクイザルに1日1回皮下投与したとき、母動物、胚・胎児発生期(妊娠20~100日)、並びに出生前及び出生後の発達時期(妊娠20日から出産を経て授乳/出生後90日まで)に毒性は誘発されませんでした。出生児の成長と発達に悪影響はなく、あるいは形態学的所見に毒性学的懸念はありませんでした。
JP-ZL-2400030
治療上の有益性及び母乳栄養の有益性を考慮して、授乳の継続又は中止を検討してください。
授乳婦に対する安全性は確立されていません。ジルコプランの母乳への移行、又は乳児が母乳を経口摂取した際の全身への吸収については不明です。
■生殖発生毒性試験
ジルコプランを投与量1、2及び4mg/kg/日で妊娠中のカニクイザルに1日1回皮下投与したとき、母動物、胚・胎児発生期(妊娠20~100日)、並びに出生前及び出生後の発達時期(妊娠20日から出産を経て授乳/出生後90日まで)に毒性は誘発されませんでした。出生児の成長と発達に悪影響はなく、あるいは形態学的所見に毒性学的懸念はありませんでした。
JP-ZL-2400030
電子添文上、特定の背景を有する患者に関する注意の項に、高齢者の規定はありません。
特別な注意喚起は行っておりません。
JP-ZL-2400030
本剤は、抗MuSK抗体陽性の患者へは投与できません。適応外となります。
ジルビスクⓇは、抗AChR抗体陽性のgMG(ステロイド剤又はステロイド剤以外の免疫抑制剤が十分に奏効しない場合に限る)の患者に投与可能な薬剤です。
JP-ZL-2400030
なぜ、髄膜炎菌ワクチンの接種が必要なのですか。
原則として、髄膜炎菌ワクチンの接種を行わないで本剤を投与することはできません。
原則として、本剤投与開始の少なくとも2週間前までに髄膜炎菌に対するワクチンを接種してください。
なぜ、髄膜炎菌ワクチンの接種が必要なのですか。
本剤は、C5の開裂及びC5bとC6の結合を阻害し、終末補体複合体C5b-9の生成を抑制すると考えられるため、髄膜炎菌をはじめとする莢膜形成細菌による感染症を発症しやすくなる可能性があります。
JP-ZL-2400030
本剤の投与を開始する前に、国内で承認されている4価結合型髄膜炎菌ワクチンの接種を行ってください。本邦において髄膜炎菌ワクチンは、菌血清群A、C、Y及びWに対する4価結合型ワクチンが承認されています。4価結合型髄膜炎菌ワクチンは免疫抑制薬を使用している場合は初回接種後2か月間隔で2回の接種を行うことが推奨されています1、2)。また、追加接種は5年ごとを目安に行うことが推奨されています3)。
なお、血清群Bに対するワクチンは国内では承認されておりません。
欧米では血清群Bに対するワクチンも承認されており、アメリカ疾病予防管理センター(CDC)はC5阻害剤で治療中の患者においては、4価結合型ワクチン及び血清群Bに対するワクチンのどちらの接種も推奨しています4、5)。
- <参考>
-
- 1)
- https://www.neurology-jp.org/news/news_20230927_01.html
- 2)
- https://www.niid.go.jp/niid/ja/usr-page/news/getart.cgi/nih.trouble/4151
- 3)
- 医療関係者のためのワクチンガイドライン第3版
http://www.kankyokansen.org/uploads/uploads/files/jsipc/vaccine-guideline_03-5.pdf - 4)
- https://www.cdc.gov/meningococcal/clinical/eculizumab.html
- 5)
- General Best Practice Guidelines for Immunization
https://www.cdc.gov/vaccines/hcp/acip-recs/general-recs/downloads/general-recs.pdf
JP-ZL-2400030
本剤の適応は、成人のみです。
小児への適応はありません。小児等を対象とした臨床試験は実施していません。
成人(15歳以上)から投与可能です。
JP-ZL-2400030
電子添文には、食前、食後、食間、就寝前といった規定はありません。
本剤は1日1回投与する薬剤であり、可能な限り同一時間帯に投与してください。
JP-ZL-2400030
他剤から本剤に切り替える場合に、どのくらいのウォッシュアウト期間が必要かについて検討する臨床試験は実施していません。
また、本剤から他剤に切り替える場合は、本剤の薬物動態、切り替え後の製品の特性等を考慮の上、ご判断ください。
参考までに、ジルビスクⓇ単回投与時の半減期は、183~201時間(約7~8日)です。
JP-ZL-2400030
■作用機序
本剤の有効成分であるジルコプランは、C5に結合しC5a及びC5bへの開裂並びにC5b及びC6の結合を阻害することにより、膜侵襲複合体(MAC)の形成及び細胞溶解活性を抑制します。
(詳細)
本剤は終末補体活性化経路の構成要素であるC5を標的とし、C5の開裂及びMAC形成の第一段階(C5bのC6への結合)の阻害という2つの作用点で下流の補体活性を抑制します。C5を標的とすることで、C3bを介したオプソニン化、C3aによる炎症反応、及び免疫複合体のクリアランス等の作用は保持されるものと考えられます1)。
また、本剤の有効成分であるジルコプランは15個のアミノ酸から構成される大環状ペプチドで、分子量が約3.6kDaと、治療用抗体(約150kDa)と比較して小さいことから、神経筋接合部への透過性がモノクローナルC5抗体と比較して高いことが示唆されます1、2)。
- <参考>
-
- 1)
- Howard JF Jr et al.: Expert Opin Investig Drugs. 2021; 30(5): 483-493.
- 2)
- Tang GQ et al.: Front Immunol. 2023; 14: 1213920.
- <引用>
- ジルビスクⓇ適正使用ガイド
Howard JF Jr et al.: Expert Opin Investig Drugs. 2021; 30(5): 483-493.を参考に作成
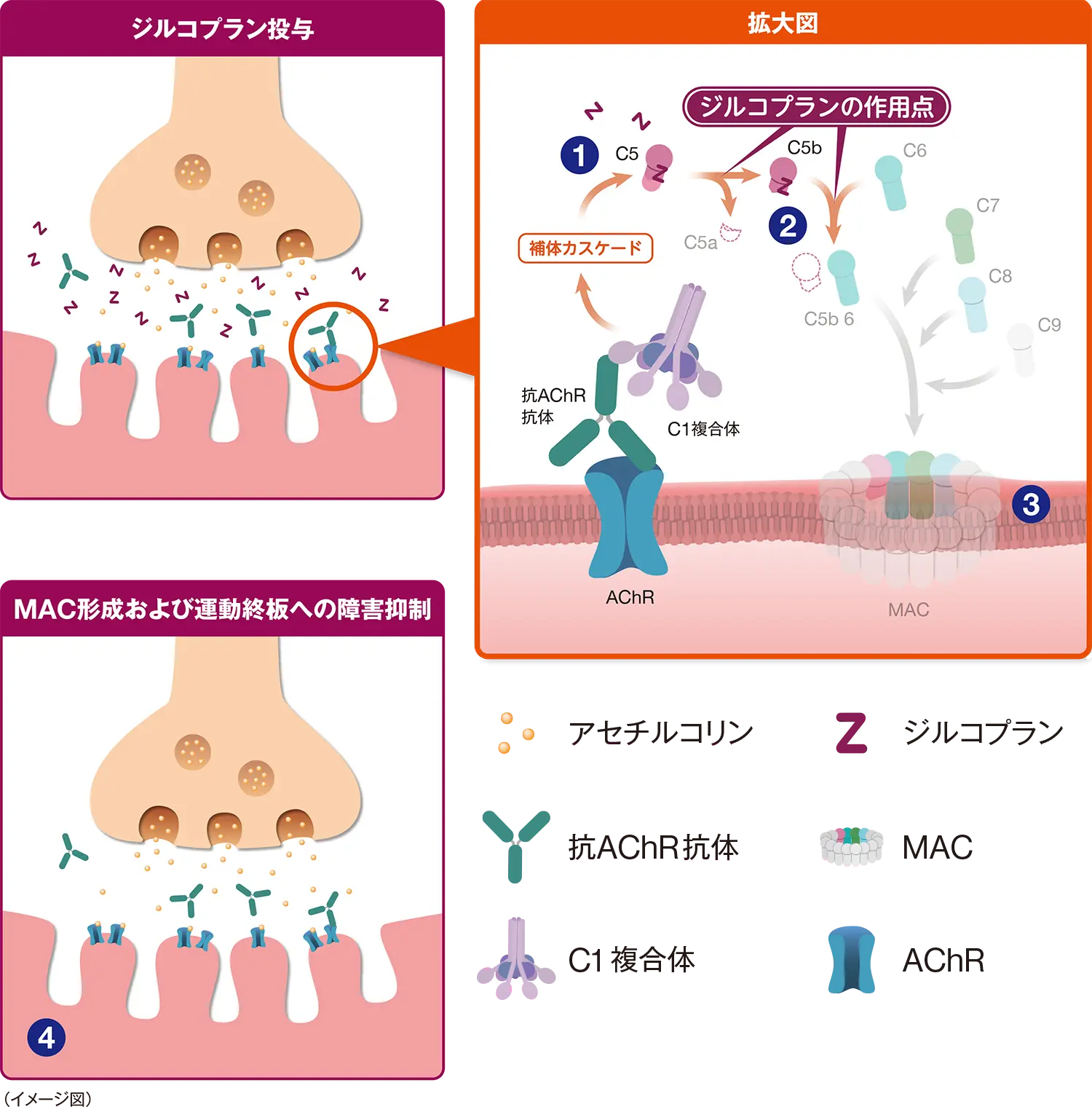
- ➊
- ジルコプランはC5のC5bに相当する部位に高い親和性で結合してC5のC5a及びC5bへの開裂を阻害し、下流の補体活性化を抑制します。
- ❷
- ジルコプランはC5のC5bに相当する部位に結合していることから、C5bが形成された場合でもC6との相互作用を立体的にブロックし、MACの形成を第一段階で阻害します。
- ❸
- ➊❷の2つの作用によりシナプス後膜でのMAC形成が阻害されます。
- ❹
- MACの形成と蓄積を阻害することで運動終板への障害が抑制され、神経筋伝達が維持されるものと推測されています。
Howard JF Jr et al.: Expert Opin Investig Drugs. 2021; 30(5): 483-493.を参考に作成
JP-ZL-2400030
電子添文「13. 過量投与」の項に、記載すべき情報はありません。
2023年12月改訂
MED-JP--2300090
JP-ZL-2400030
