ご利用にあたってのご注意
このQ&Aに記載の情報は、製品の適正使用にあたっての参考情報であり、すべての患者さん/事例にあてはまるものではありません。
そのため、Q&Aの利用に関して生じた結果については、責任を負いかねますので、ご了承ください。
また、国内で承認されていない効能又は効果/用法及び用量等の情報を含む場合がありますが、弊社としてこれらの使用を推奨するものではありません。
製品のご使用にあたっては、最新の電子化された添付文書をご確認ください。
製品に関してご不明な点がございましたら、弊社ユーシービーケアーズ コンタクトセンター(0120-093-189)にお問い合わせください。なお、本Q&Aを
許可なく複写、複製、転掲、改変、配布等を行うことは固くお断りします。
ヒト化抗ヒトIL-17A/IL-17Fモノクローナル抗体製剤
ビンゼレックス®
- ビンゼレックス®
皮下注320㎎ オートインジェクター - ビンゼレックス®
皮下注160㎎ オートインジェクター - ビンゼレックス®
皮下注160㎎ シリンジ
効能又は効果
既存治療で効果不十分な下記疾患
○尋常性乾癬、膿疱性乾癬、乾癬性紅皮症
○乾癬性関節炎
○強直性脊椎炎、X線基準を満たさない体軸性脊椎関節炎
化膿性汗腺炎
なお、本剤の電子化された添付文書の「5. 効能又は効果に関連する注意」に次の記載があります。
〈尋常性乾癬、膿疱性乾癬、乾癬性紅皮症〉
5.1 以下のいずれかを満たす患者に投与すること。
・光線療法を含む既存の全身療法(生物製剤を除く)で十分な効果が得られず、皮疹が体表面積の10%以上に及ぶ患者。
・難治性の皮疹又は膿疱を有する患者。
〈乾癬性関節炎〉
5.2 既存の全身療法(従来型合成疾患修飾性抗リウマチ薬等)で十分な効果が得られない、難治性の関節症状を有する患者に投与すること。
〈強直性脊椎炎〉
5.3 過去の治療において、既存治療薬(非ステロイド性抗炎症剤等)による適切な治療を行っても、疾患に起因する明らかな臨床症状が残る場合に投与すること。
〈X線基準を満たさない体軸性脊椎関節炎〉
5.4 過去の治療において、既存治療薬(非ステロイド性抗炎症剤等)による適切な治療を行っても、疾患に起因する明らかな臨床症状及び炎症の客観的徴候が認められる場合に投与すること。
〈化膿性汗腺炎〉
5.5化膿性汗腺炎に対し局所療法や抗菌薬の投与が必要となる患者には、これらの治療を行っても臨床症状が残る場合に投与すること。また、化膿性汗腺炎では繰り返す病変部位に二次的に細菌感染が発生することがあり、病変部位の適切な管理が求められる。
5.6本剤の軽度の化膿性汗腺炎患者における有効性及び安全性は確立していない。「17.臨床成績」の項の内容、並びに本剤の有効性及び安全性を十分に理解した上で適応患者の選択を行うこと。
2024年9月改訂
MED-JP--2200010
用法及び用量
〈尋常性乾癬、膿疱性乾癬、乾癬性紅皮症〉
通常、成人にはビメキズマブ(遺伝子組換え)として、1回320mgを初回から16週までは4週間隔で皮下注射し、以降は8週間隔で皮下注射する。
なお、患者の状態に応じて16週以降も4週間隔で皮下注射できる。
〈乾癬性関節炎〉
通常、成人にはビメキズマブ(遺伝子組換え)として、1回160mgを4週間隔で皮下注射する。
〈強直性脊椎炎、X線基準を満たさない体軸性脊椎関節炎〉
通常、成人にはビメキズマブ(遺伝子組換え)として、1回160mgを4週間隔で皮下注射する。
〈化膿性汗腺炎〉
通常、成人にはビメキズマブ(遺伝子組換え)として、1回320mgを初回から16週までは2週間隔で皮下注射し、以降は4週間隔で皮下注射する。
なお、投与間隔は患者の状態に応じて適宜2週間隔又は4週間隔を選択することができる。
なお、本剤の電子化された添付文書の「7. 用法及び用量に関連する注意」に次の記載があります。
7.1 本剤と他の生物製剤や経口ヤヌスキナーゼ(JAK)阻害剤の併用について安全性及び有効性は確立していないので併用を避けること。
7.2 本剤による治療反応は、通常投与開始から16週以内に得られる。16週以内に治療反応が得られない場合は本剤の治療計画の継続を慎重に再考すること。
2024年9月改訂
MED-JP--2200010
ビメキズマブは、IL-17A及びIL-17Fに選択的に結合し、中和します。
2024年9月改訂
MED-JP--2200010
本剤の電子化された添付文書に次の記載があります。
1.警告
1.1 本剤は結核等の感染症を含む緊急時に十分に対応できる医療施設において、本剤についての十分な知識と適応疾患の治療に十分な知識・経験をもつ医師のもとで、本剤による治療の有益性が危険性を上回ると判断される症例のみに使用すること。
本剤は感染症のリスクを増大させる可能性があり、また結核の既往歴を有する患者では結核を活動化させる可能性がある。また、本剤との関連性は明らかではないが、悪性腫瘍の発現が報告されている。治療開始に先立ち、本剤が疾病を完治させる薬剤でないことも含め、本剤の有効性及び危険性を患者に十分説明し、患者が理解したことを確認した上で治療を開始すること。
1.2 重篤な感染症
ウイルス、細菌及び真菌等による重篤な感染症が報告されているため、十分な観察を行うなど感染症の発症に注意し、本剤投与後に感染の徴候又は症状があらわれた場合には、直ちに担当医に連絡するよう患者を指導すること。
1.3 本剤の治療を開始する前に、適応疾患の既存治療の適用を十分に勘案すること。
2024年9月改訂
MED-JP--2200010
本剤の電子化された添付文書に次の記載があります。
2.禁忌(次の患者には投与しないこと)
2.1 重篤な感染症の患者[症状を悪化させるおそれがある。]
2.2 活動性結核の患者[症状を悪化させるおそれがある。]
2.3 本剤の成分に対し過敏症の既往歴のある患者
2024年9月改訂
MED-JP--2200010
〇 生ワクチンについて:本剤の電子化された添付文書に次の記載があります。
8. 重要な基本的注意
8.3本剤投与中は、生ワクチン接種による感染症発現のリスクを否定できないため、生ワクチン接種は行わないこと。
〇 生ワクチン以外のワクチンについて:本剤の電子化された添付文書に、生ワクチン以外のワクチン接種に関する記載はありません。
2024年9月改訂
MED-JP--2200010
本剤の電子化された添付文書に次の記載があります。
11.副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1 重大な副作用
11.1.1 重篤な感染症(0.5%)
本剤は感染のリスクを増大させる可能性がある。投与中に重篤な感染症があらわれた場合や標準治療により改善が認められない場合は、患者の状態を十分に観察し、感染症が消失するまで本剤を投与しないこと。
11.1.2 好中球数減少(0.7%)
11.1.3 炎症性腸疾患(0.3%)
11.1.4 重篤な過敏症反応(0.1%未満)
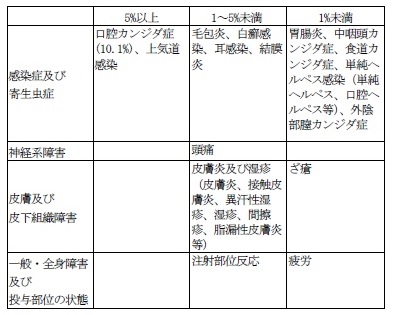
11.2 その他の副作用
2024年9月改訂
MED-JP--2200010
本剤の電子化された添付文書の「11.副作用 11.2その他の副作用」の5%以上の項に、「口腔カンジダ症(10.1%)」の記載があります。
「17.臨床成績」の項に、各適応疾患の臨床試験における発現頻度の記載があります。
〈尋常性乾癬〉
17.1.1 国際共同第Ⅲ相二重盲検試験(PS0009): 口腔カンジダ症12.4%(49/395例)
17.1.2 海外第Ⅲ相二重盲検試験(PS0008): 口腔カンジダ症14.3%(67/468例)
17.1.3 海外第Ⅲ相二重盲検試験(PS0013): 口腔カンジダ症7.4%(26/349例)
〈膿疱性乾癬及び乾癬性紅皮症〉
17.1.4 国際共同第Ⅲ相非盲検試験(PS0014 日本人コホート)乾癬性紅皮症患者: 口腔カンジダ症27.3%(3/11例)
〈乾癬性関節炎〉
17.1.5 国際共同第Ⅲ相二重盲検試験(PA0010): 口腔カンジダ症4.1%(29/702例)
17.1.6 国際共同第Ⅲ相二重盲検試験(PA0011): 口腔カンジダ症2.2%(6/267例)
〈強直性脊椎炎〉
17.1.7 国際共同第Ⅲ相二重盲検試験(AS0011): 口腔カンジダ症5.5%(18/330例)
〈X線基準を満たさない体軸性脊椎関節炎〉
17.1.8 国際共同第Ⅲ相二重盲検試験(AS0010): 口腔カンジダ症5.7%(14/244例)
〈化膿性汗腺炎〉
17.1.9 国際共同第Ⅲ相二重盲検試験(HS0004): 口腔カンジダ症10.8%(54/501例)
17.1.10 海外第Ⅲ相二重盲検試験(HS0003): 口腔カンジダ症7.9%(39/494例)
2024年9月改訂
MED-JP--2200010
本剤の電子化された添付文書の「11.副作用 11.2その他の副作用」の1~5%未満の項に、「注射部位反応」の記載があります。
2024年9月改訂
MED-JP--2200010
本剤の電子化された添付文書の「9.特定の背景を有する患者に関する注意」に、腎機能障害患者への投与についての記載はありません。
2024年9月改訂
MED-JP--2200010
本剤の電子化された添付文書の「9.特定の背景を有する患者に関する注意」に、肝機能障害患者への投与についての記載はありません。
2024年9月改訂
MED-JP--2200010
本剤の電子化された添付文書に次の記載があります。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。本剤はカニクイザルにおいて胎児への移行が報告されている。
2024年9月改訂
MED-JP--2200010
本剤の電子化された添付文書に次の記載があります。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。本剤のヒト乳汁への移行性については不明であるが、一般にヒトIgGは乳汁中へ移行することが知られている。
2024年9月改訂
MED-JP--2200010
本剤には小児への適応はありません。
本剤の電子化された添付文書に次の記載があります。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
2024年9月改訂
MED-JP--2200010
本剤の電子化された添付文書に次の記載があります。
9.8 高齢者
感染症等の副作用の発現に留意し、十分な観察を行うこと。一般に生理機能が低下している。
2024年9月改訂
MED-JP--2200010
本剤の電子化された添付文書に保管について次の記載があります。
貯法: 2 ~ 8 ℃で保存
20. 取扱い上の注意
20.1 凍結を避けて、冷蔵庫で保管すること。25℃以下で保管する場合には、30日以内に使用すること。
20.2 本剤は外箱にいれた状態で遮光保存すること。
2024年9月改訂
MED-JP--2200010
本剤の電子化された添付文書に次の記載があります。
3.1 組成

3.2 製剤の性状

2024年9月改訂
MED-JP--2200010
本剤の電子化された添付文書に投与部位について次の記載があります。
14.適用上の注意
14.2 薬剤投与時の注意
14.2.1 投与部位は、腹部、大腿部又は上腕部が望ましい。
14.2.2 皮膚が敏感な部位、あざ、発赤、硬結、瘢痕、皮膚線条がある部位、乾癬の部位には注射しないこと。
14.2.3 臍部から5 cm以内に本剤を投与しないこと。
14.2.4 同一箇所への2 本の注射は避け、投与毎に注射部位を変えること。」
2024年9月改訂
MED-JP--2200010
本剤の電子化された添付文書に自己投与について次の記載があります。自己投与は4週間隔以内の投与の場合のみ、医師の管理指導のもとで実施することができます。
8. 重要な基本的注意
8.6 自己投与は4週間隔以内の投与の場合のみとすること。本剤の投与開始にあたっては、医療施設において、必ず医師によるか、医師の直接の監督のもとで投与を行うこと。自己投与の適用については、医師がその妥当性を慎重に検討し、十分な教育訓練を実施したのち、本剤投与による危険性と対処法について患者が理解し、患者自ら確実に投与できることを確認した上で、医師の管理指導のもとで実施すること。また、適用後、感染症等本剤による副作用が疑われる場合や自己投与の継続が困難な状況となる可能性がある場合には、直ちに自己投与を中止させ、医師の管理下で慎重に観察するなど適切な処置を行うこと。使用済みの注射器(注射針一体型)を再使用しないように患者に注意を促し、安全な廃棄方法に関する指導を行うこと。
2024年9月改訂
MED-JP--2200010
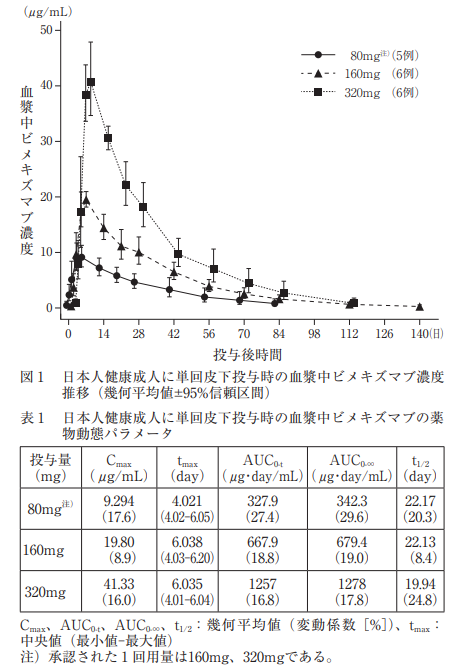
本剤の電子化された添付文書の「16. 薬物動態」の表1に薬物動態パラメータの記載があります。
16.薬物動態
16.1 血中濃度
16.1.1 単回投与
日本人健康成人に本剤80mg注)、160mg及び320mgを単回皮下投与した時の血漿中ビメキズマブ濃度時間推移及び薬物動態パラメータを図1及び表1に示す。血漿中ビメキズマブ濃度は投与量に比例して増加し、いずれの投与量においても4~6日で最高血漿中濃度に到達した後、20~22日の半減期で低下した。
注)承認された1回用量は160mg、320mgである。
2024年9月改訂
MED-JP--2200010
本剤の電子化された添付文書の「16.1.3 母集団薬物動態解析」にバイオアベイラビリティの記載があります。
16.1.3 母集団薬物動態解析
母集団薬物動態解析より健康成人における絶対的バイオアベイラビリティの平均は70.1%、尋常性乾癬患者における半減期の平均は23日、見かけのクリアランス及び分布容積の中央値(変動係数%)は0.337(32.7%)L/day及び11.2(30.5%)Lと推定された。
本剤320mgの皮下投与において、体重が120kg以上の成人患者の平均血漿中ビメキズマブ濃度は、90kgの成人患者より少なくとも30%低いと推定された。
母集団薬物動態解析より、尋常性乾癬患者、乾癬性関節炎患者、強直性脊椎炎患者及びX線基準を満たさない体軸性脊椎関節炎患者の間で、薬物動態特性は類似すると推定された。本解析から、ビメキズマブのクリアランスは、メトトレキサートの併用投与によって影響を受けないと推定された。
化膿性汗腺炎患者のデータを含めた母集団薬物動態解析より、体重が90kgの場合、化膿性汗腺炎患者では尋常性乾癬患者、乾癬性関節炎患者、強直性脊椎炎患者及びX線基準を満たさない体軸性脊椎関節炎患者と比べ見かけのクリアランス及び分布容積がそれぞれ31%及び18%高いと推定された。半減期は20日であった。結果として本剤320mgを4週毎に皮下投与した時の血漿中ビメキズマブ濃度のトラフ値は化膿性汗腺炎以外の患者に比べ約40%低かった。
2024年9月改訂
MED-JP--2200010
