国内第Ⅱ/Ⅲ相試験(PsV、PsA)
〈尋常性乾癬患者(乾癬性関節炎の合併例を含む)〉
PASI反応率〔主要評価項目(検証項目)/副次評価項目:16週時のPASI75/90反応率〕
16週時のPASI75反応率(FAS-MCMC)a)は、シムジア®400mgQ2W群で87.1%、シムジア®200mgQ2W群で73.0%、プラセボ群で7.9%であり、いずれもプラセボ群に比べ有意に高いことが検証されました(いずれもp<0.0001:ロジスティック回帰分析)。
- PASI90反応率(FAS-NRI)b)
-
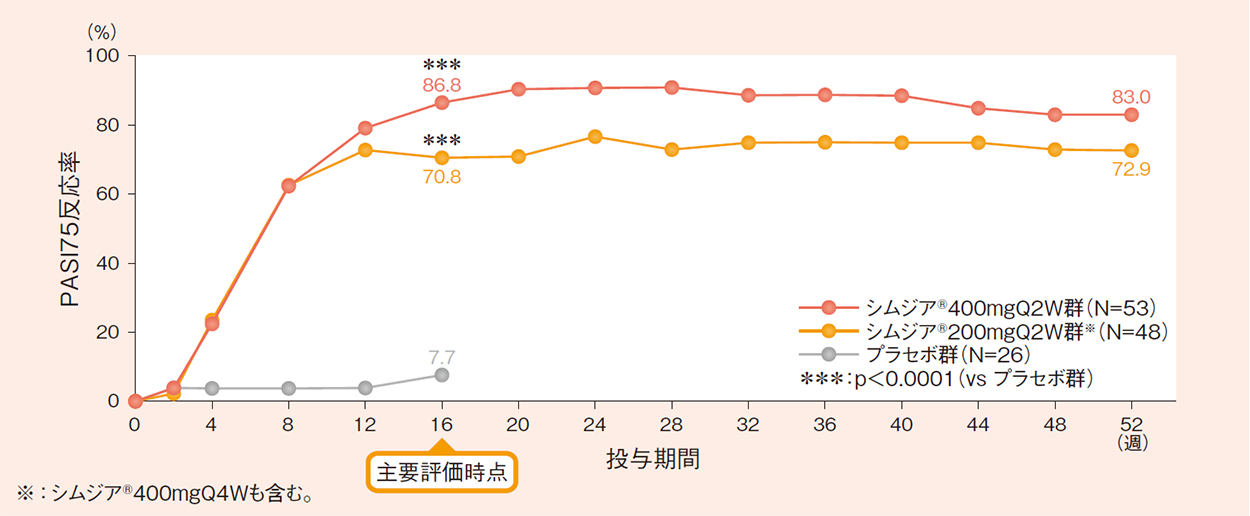
a)MCMC法を用いて欠測値を補完した。
b)NRI法を用いて欠測値を補完した。
16週時のPASI75及びPASI90反応率、ならびにPGA 0/1達成率は、MCMC法による解析を主解析、NRI法による解析を補足的解析として評価した。 また、0~52週の有効性評価項目(主要及び副次評価項目)は、試験全体の推移を把握するため、NRI法による補足的解析結果を記述した。
p値は投与群及び過去の生物学的製剤の使用の有無を因子としたロジスティック回帰分析(有意水準:両側2.5%)を用いて算出した。
PASI:乾癬面積・重症度指標、FAS:最大の解析対象集団、MCMC法:マルコフ連鎖モンテカルロ法、NRI:Non-responder imputation
- BMIで3区分した16週時のPASI90反応率(FAS-NRI)〔部分集団解析〕
-
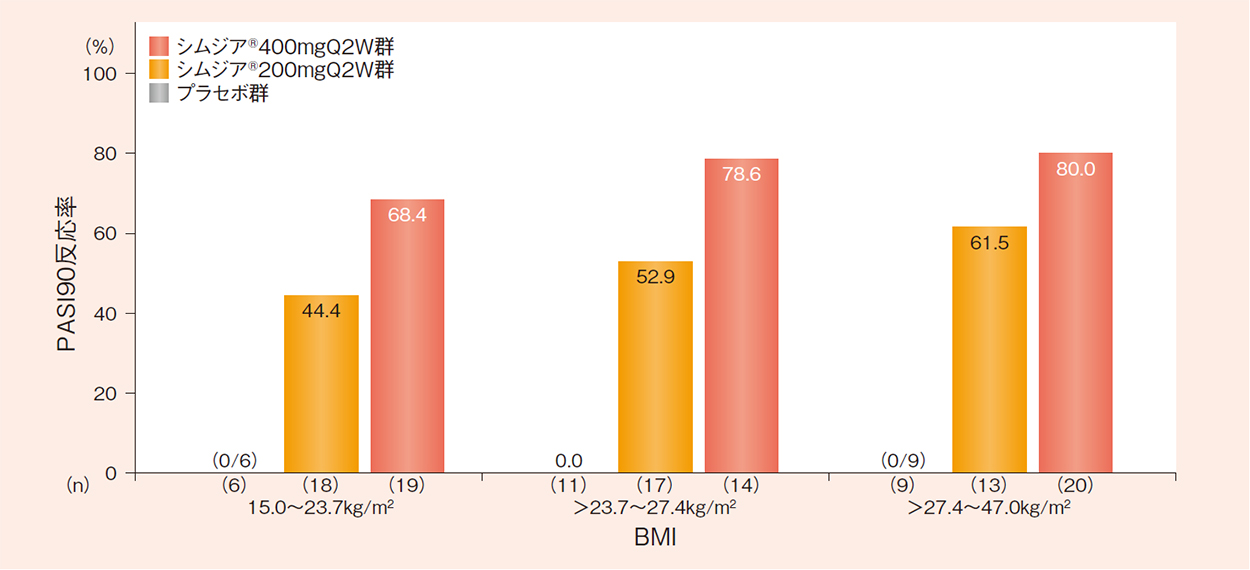
NRI法を用いて欠測値を補完した。
BMI:体格指数、PASI:乾癬面積・重症度指標、FAS:最大の解析対象集団、NRI:Non-responder imputation
乾癬性関節炎患者の皮膚症状及び関節症状に対する効果
ベースライン時の圧痛関節数及び腫脹関節数がいずれも3以上(OJS3+)認められた乾癬性関節炎患者におけるPASI/DAS28-CRP/ACR反応は以下のとおりでした。
- PASI/DAS28-CRP/ACR反応(PsA-OJS3+)〔部分集団解析〕
-
投与群 皮膚症状 PASI PASI反応(16週) 投与前 16週 変化量 変化率(%) PASI50 PASI75 PASI90 PASI100 シムジア®
200mg
Q2W群18.9 4.8 -14.1 -74.60 Yes No No No 28.8 15.6 -13.2 -45.83 No No No No 14.7 13.0 -1.7 -11.56 No No No No シムジア®
400mg
Q2W群27.9 0.9 -27.0 -96.77 Yes Yes Yes No 15.0 1.8 -13.2 -88.00 Yes Yes No No 21.3 0 -21.3 -100.00 Yes Yes Yes Yes 15.3 6.6 -8.7 -56.86 Yes No No No 12.4 1.2 -11.2 -90.32 Yes Yes Yes No 投与群 関節症状 DAS28-CRP ACR反応(16週) 投与前 16週 変化量 変化率(%) ACR20 ACR50 ACR70 シムジア®
200mg
Q2W群5.707 4.853 -0.854 -14.96 No No No 2.569 2.555 -0.014 -0.54 No No No 5.354 6.398 1.044 19.49 No No No シムジア®
400mg
Q2W群2.923 1.751 -1.172 -40.09 Yes Yes Yes 2.898 2.120 -0.779 -26.87 No No No 5.214 1.072 -4.142 -79.44 Yes Yes Yes 6.277 1.280 -4.998 -79.62 Yes Yes Yes 4.554 1.800 -2.754 -60.47 Yes Yes No PASI:乾癬面積・重症度指標、DAS28:28関節疾患活動性スコア、CRP:C反応性蛋白、ACR:米国リウマチ学会、OJS3+:ベースライン時の圧痛関節数及び腫脹関節数がいずれも3以上の患者
安全性
52週までの期間に発現した副作用は、シムジア®投与群全体で122例中39例(32.0%)に認められました。主な副作用はシムジア®投与群全体で鼻咽頭炎5例(4.1%)、乾癬4例(3.3%)等でした。
重篤な副作用は、シムジア®投与群全体で5例に認められ、潜伏結核2例、好中球減少症、血小板減少症、サルコイドーシス、帯状疱疹各1例でした(潜伏結核1例及び帯状疱疹は同一症例で発現)。
投与中止に至った有害事象は、シムジア®投与群全体で9例に認められ、乾癬4例、血小板減少症、肝障害、アルコール性肝疾患、AST増加、間質性肺疾患各1例でした。
本試験において死亡に至った有害事象は認められませんでした。
なお、0〜16週では、プラセボ群26例中6例(23.1%)に副作用が認められ、乾癬3例(11.5%)等でした。投与中止に至った有害事象は乾癬2例でした。16週までに重篤な副作用及び死亡に至った有害事象は、プラセボ群で認められませんでした。
16~52週では、プラセボ群4例中1例(25.0%)に副作用が認められました。重篤な副作用、投与中止に至った有害事象及び死亡に至った有害事象は認められませんでした。
試験概要
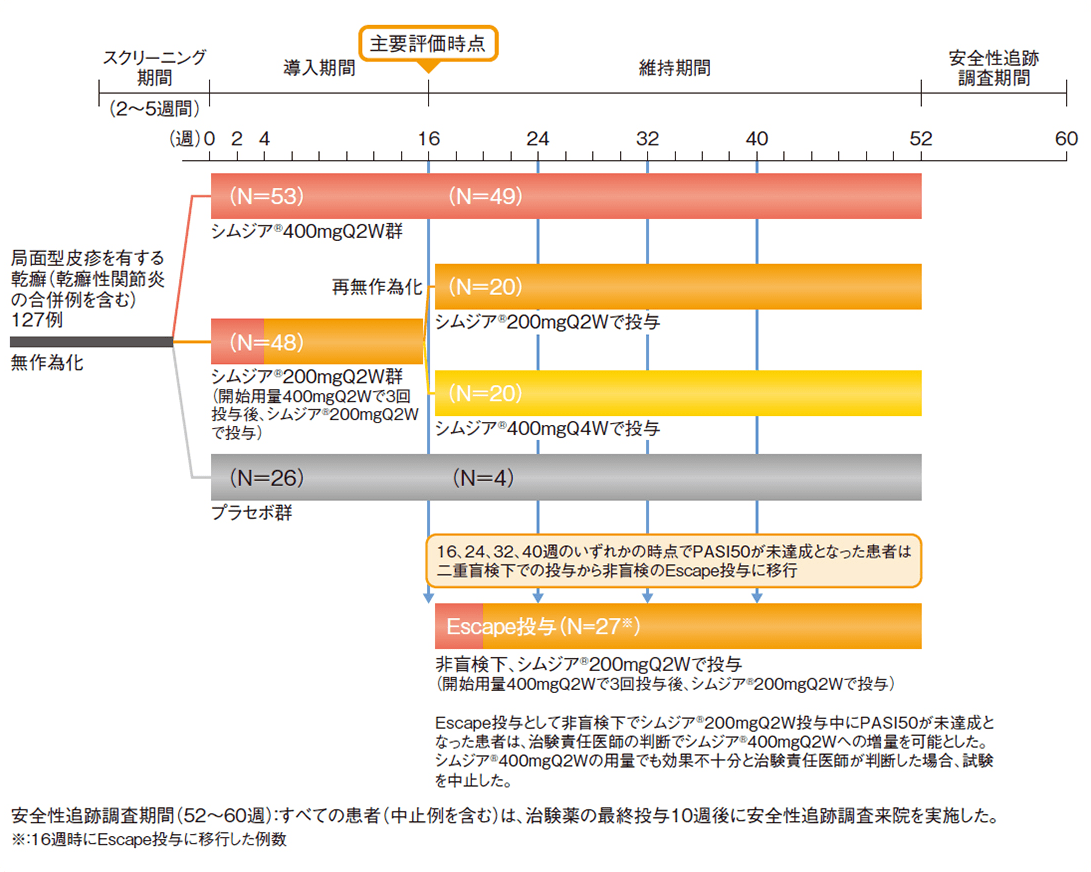
Q2W:2週間隔、Q4W:4週間隔
- 対象
-
中等度~重度の尋常性乾癬患者(乾癬性関節炎の合併例を含む) 127 例
・局面型皮疹を有する乾癬(尋常性乾癬及び乾癬性関節炎)の診断を受けて6ヵ月以上経過している患者
・ベースラインのPASIスコア≧12、病変BSA≧10%、及びPGAスコア≧3の患者
・乾癬の全身療法及び/又は光線療法及び/又は光化学療法の対象となる患者[ただし、乾癬性紅皮症又は膿疱性乾癬の患者、過去にシムジア®を投与された患者、乾癬又は乾癬性関節炎の治療のために3種類以上の生物学的製剤(TNF阻害薬を含む)を使用した患者を除く]
- デザイン
-
多施設共同、二重盲検、無作為化、プラセボ対照、並行群間比較
- 投与方法
-
シムジア®400mgQ2W群、シムジア®200mgQ2W群又はプラセボ群のいずれかに2:2:1の割合で無作為に割り付け、2週間隔で14週時まで皮下投与した(シムジア®200mgQ2W群はシムジア®400mgQ2Wで3回投与後、シムジア®200mgQ2Wで投与)。16週時にPASI50を達成したシムジア®400mgQ2W群及びプラセボ群の患者は投与を継続、シムジア®200mgQ2W群の患者はシムジア®200mgQ2W投与又はシムジア®400mgQ4W投与に1:1の割合で再割付けし、皮下投与した。また、16、24、32、40週時のいずれかの時点でPASI50が未達成となった患者は、Escape投与に移行し、非盲検下、シムジア®400mgQ2Wで3回投与後、シムジア®200mgQ2Wで皮下投与した。
- 評価項目
-
主要評価項目:16週時のPASI75反応率(検証項目)
副次評価項目:16週時のPASI90反応率 等
その他の評価項目:乾癬性関節炎の部分集団におけるPASI、DAS28-CRPのベースラインからの変化、ACR20/50/70反応率 等
- 解析計画
-
主要評価項目及び主な副次評価項目の統計解析は多重性を考慮し、固定順検定法を用いた。閉検定手順は、主要評価項目におけるシムジア®200mgQ2W群とプラセボ群の比較、シムジア®400mgQ2W群とプラセボ群の比較をそれぞれ有意水準両側2.5%で実施し、統計学的な有意差が認められた場合には、投与群毎に副次評価項目の仮説検定を有意水準両側2.5%の下、実施することとされた。各投与群において事前に規定した副次評価項目の全てで統計学的有意差が認められた場合には、有意水準両側2.5%をもう一方の投与群の解析に受け渡す計画とされた。
16週時のPASI75及びPASI90反応率、ならびにPGA 0/1達成率におけるシムジア®の各投与群とプラセボ群との比較は、投与群及び過去の生物学的製剤の使用の有無を因子としたロジスティック回帰分析を用いて解析し、オッズ比、信頼区間及びp値で示した。16週時のPASI75及びPASI90反応率、ならびにPGA 0/1達成率に対して部分集団解析(BMI別等)を実施し、記述統計量のみを算出した。部分集団の1つ以上のカテゴリーの患者数が全患者の10%未満だった場合は、その部分集団の解析を実施しなかった。また、PASI90維持率に対して部分集団解析を実施した。なお、部分集団解析は事前に規定されていた。
乾癬性関節炎に関する評価は、ベースライン時の圧痛関節数及び腫脹関節数がいずれも3以上の患者(OJS3+)を対象とした。
16週時のPASI75及びPASI90反応率、ならびにPGA 0/1達成率は、MCMC法による解析を主解析、NRI法による解析を補足的解析として評価した。また、0~52週の有効性評価項目(主要及び副次評価項目)は、試験全体の推移を把握するため、NRI法による補足的解析結果を記述した。
承認時評価資料 : 国内第Ⅱ/Ⅲ相二重盲検比較試験成績 PS0017試験
- 6. 用法及び用量(抜粋)
- 〈尋常性乾癬、乾癬性関節炎、膿疱性乾癬、乾癬性紅皮症〉
通常、成人にはセルトリズマブ ペゴル(遺伝子組換え)として、1回400mgを2週間の間隔で皮下注射する。症状安定後には、1回200mgを2週間の間隔、又は1回400mgを4週間の間隔で皮下注射できる。
国内第Ⅱ/Ⅲ相試験(EP、GPP)
〈乾癬性紅皮症及び膿疱性乾癬患者〉
臨床全般印象改善度(CGI-I)の経時的推移
両疾患におけるCGI-Iの改善は以下のとおりでした。
- CGI-Iの経時的推移(CFAS-NRI)
-
寛解+改善 乾癬性紅皮症 膿疱性乾癬 シムジア®200mg
Q2W群(N=7)シムジア®400mg
Q2W群(N=8)シムジア®200mg
Q2W群(N=4)シムジア®400mg
Q2W群(N=3)2週 4/7 5/8 3/4 3/3 4週 6/7 7/8 4/4 3/3 8週 5/7 7/8 4/4 3/3 12週 6/7 7/8 4/4 3/3 16週 6/7 8/8 4/4 3/3 寛解+改善 乾癬性紅皮症 シムジア®200mgQ2W/
シムジア®200mgQ2W群
(N=4)シムジア®400mgQ2W/
シムジア®400mgQ2W群
(N=8)シムジア®200mgQ2W/
シムジア®400mgQ2W群
(N=2)16週 4/4 8/8 2/2 20週 3/4 7/8 2/2 24週 4/4 8/8 2/2 28週 4/4 7/8 2/2 32週 3/4 7/8 2/2 36週 3/4 6/8 2/2 40週 3/4 7/8 2/2 44週 3/4 7/8 2/2 48週 3/4 7/8 2/2 52週 3/4 7/8 2/2 寛解+改善 膿疱性乾癬 シムジア®200mgQ2W/
シムジア®200mgQ2W群
(N=3)シムジア®400mgQ2W/
シムジア®400mgQ2W群
(N=3)シムジア®200mgQ2W/
シムジア®400mgQ2W群
(N=1)16週 3/3 3/3 1/1 20週 3/3 3/3 1/1 24週 3/3 3/3 1/1 28週 3/3 3/3 1/1 32週 3/3 3/3 1/1 36週 3/3 3/3 1/1 40週 3/3 3/3 1/1 44週 3/3 3/3 1/1 48週 3/3 3/3 1/1 52週 3/3 2/3 1/1 NRI法を用いて欠測値を補完した。
CGI-I:臨床全般印象改善度、CFAS:非盲検コホート最大解析対象集団、NRI:Non-responder imputation
安全性
52週までの期間に発現した副作用は、乾癬性紅皮症及び膿疱性乾癬において、15例中6例(40.0%)及び7例中3例(42.9%)に認められ、乾癬性紅皮症で乾癬2例(13.3%)、注射部位反応、単純ヘルペス、帯状疱疹、せつ、潜伏結核、咽頭炎、ALT増加、多形紅斑、光線過敏性反応各1例(6.7%)、膿疱性乾癬で好中球減少症、体部白癬、ざ瘡各1例(14.3%)でした。
重篤な副作用は、乾癬性紅皮症で多形紅斑1例、膿疱性乾癬で好中球減少症1例でした。
投与中止に至った有害事象は、乾癬性紅皮症で3例に認められ、潜伏結核、多形紅斑、乾癬各1例でした。膿疱性乾癬では、本試験において投与中止に至った有害事象は認められませんでした。
乾癬性紅皮症及び膿疱性乾癬のいずれにおいても、本試験において死亡に至った有害事象は認められませんでした。
試験概要
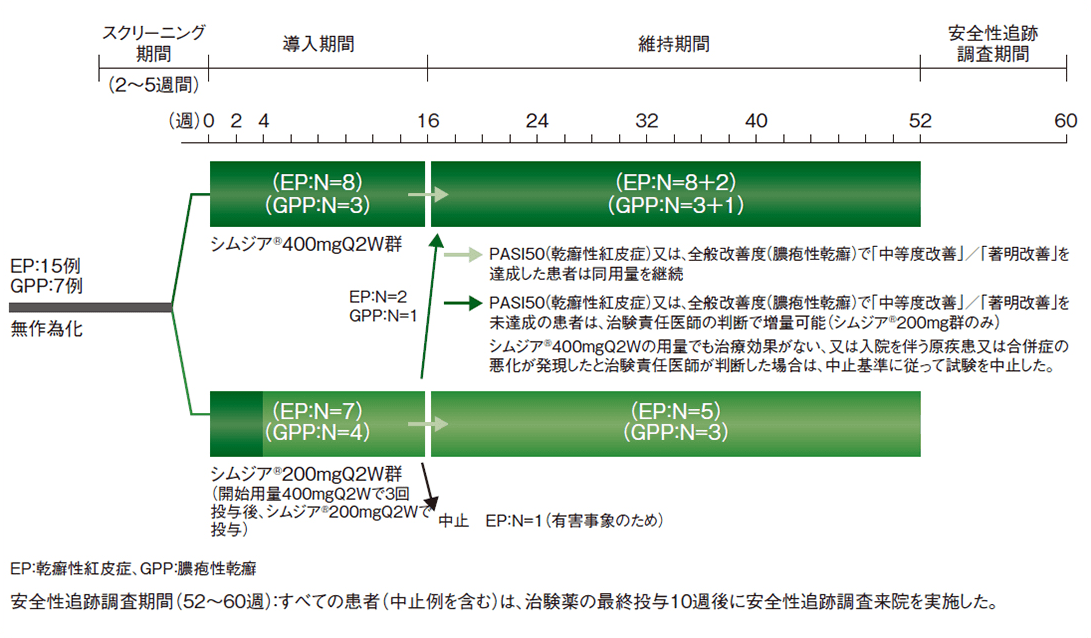
Q2W:2週間隔
- 対象
-
乾癬性紅皮症及び膿疱性乾癬患者 22例
・乾癬性紅皮症:尋常性乾癬等の局面型皮疹を伴う乾癬の病歴があり、病変BSA≧80%の患者
・膿疱性乾癬:日本皮膚科学会(JDA)の診断基準を満たす患者[ただし、膿疱性乾癬患者でベースライン時にJDA重症度分類スコアの合計点数が14以上の患者、乾癬性紅皮症以外による紅皮症(リンパ腫や薬剤性発疹による紅皮症等)の患者、及び過去に生物学的製剤を使用して一次無効(治療開始から12週間の間に効果が得られなかった場合)であった治療歴を有する患者を除く]
- デザイン
-
多施設共同、非盲検、無作為化
- 方法
-
シムジア®200mgQ2W群又はシムジア®400mgQ2W群のいずれかに1:1の割合で無作為に割り付け、2週ごとに1回、14週間皮下投与した。16週時に全般改善度で「中等度改善」以上(膿疱性乾癬)/PASI50(乾癬性紅皮症)を達成した患者は同用量を継続し、未達成の患者は、医師の判断で継続、増量(200mg群の患者)又は中止した。
- 評価項目
-
臨床全般印象改善度(CGI-I)、PASI75/90反応率(乾癬性紅皮症)、全般改善度(膿疱性乾癬) 等
承認時評価資料 : 国内第Ⅱ/Ⅲ相二重盲検比較試験成績 PS0017試験
- 6. 用法及び用量(抜粋)
- 〈尋常性乾癬、乾癬性関節炎、膿疱性乾癬、乾癬性紅皮症〉
通常、成人にはセルトリズマブ ペゴル(遺伝子組換え)として、1回400mgを2週間の間隔で皮下注射する。症状安定後には、1回200mgを2週間の間隔、又は1回400mgを4週間の間隔で皮下注射できる。
海外第Ⅲ相試験(RAPID-PsA試験)〔海外データ〕
〈乾癬性関節炎患者〉
ACR20/50/70反応率(12週時のACR20反応率:主要評価項目)
12週時のACR20反応率は、シムジア®両投与群で、プラセボ群に比べ有意に高いことが示されました(p<0.001:Wald漸近検定)。
- 12週時のACR20/50/70反応率(RS-NRI)
-
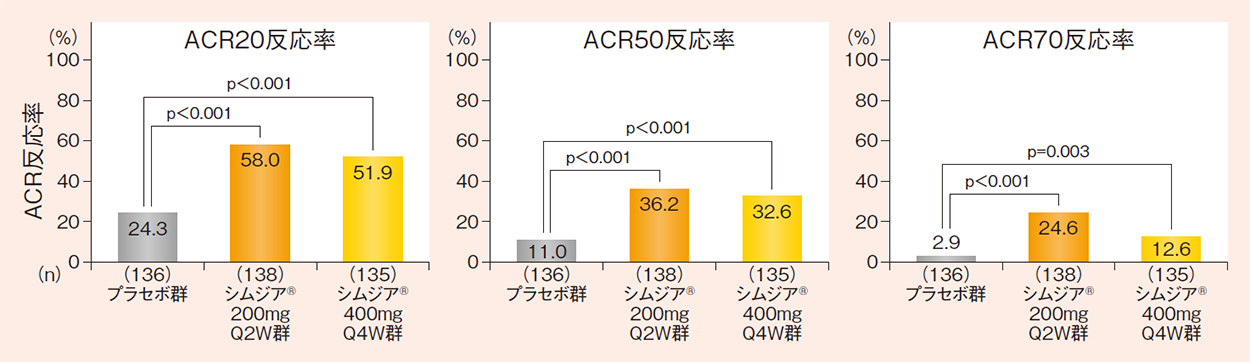
NRI法を用いて欠測値を補完した。
p値はWald漸近検定(有意水準両側5%)を用いて算出した。
ACR:米国リウマチ学会、RS:無作為化解析対象集団、NRI:Non-responder imputation
- mTSSのベースラインからの変化量(24週時:主要評価項目、48週時:副次評価項目)
-
シムジア®200mgQ2W群及び400mgQ4W群のmTSSのベースラインからの変化量は、24週時でそれぞれ0.01及び0.11、48週時でそれぞれ0.15及び0.11でした※。
- 24週時及び48週時のmTSSのベースラインからの変化量(RS-線形外挿法)
-
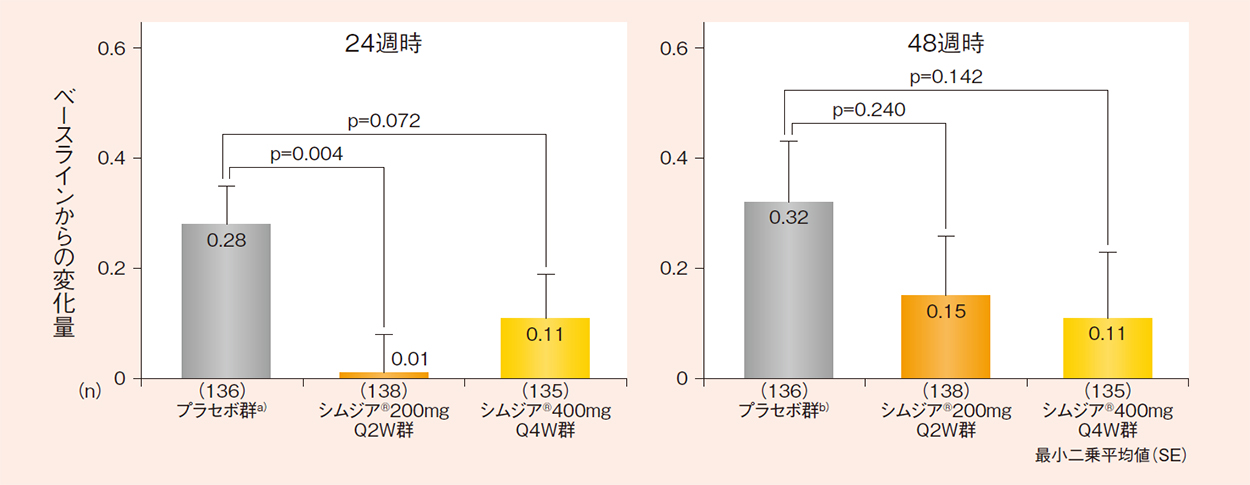
最小二乗平均値(SE)
線形外挿法を用いて欠測値を補完した。
a)線形外挿法はEscape投与へ移行した患者に対して適用した。 p値は投与群、地域及び過去のTNF阻害薬の使用の有無を因子とし、ベースライン値を共変量としたANCOVAを用いて算出した。
※:当初の解析計画書で規定した欠測値補完ルールを用いた解析結果では、臨床的に考えにくい値となったことから、補完ルールが適切ではない可能性が示唆された。X線検査間の許容期間を最小8週間とする等の変更を加えた新たな欠測値補完ルールを適用した事後解析を実施した。
mTSS:modified Total Sharp Score、RS:無作為化解析対象集団
付着部炎、指炎、爪病変の改善
シムジア®投与(200mgQ2Wと400mgQ4Wを併合)により、付着部炎/指炎/爪病変が消失した患者の割合は、216週時でそれぞれ70.9%、80.8%、64.5%でした。
- 付着部炎/指炎/爪病変の消失率 (ベースラインで付着部炎/指炎/爪病変を有する患者-LOCF)
-
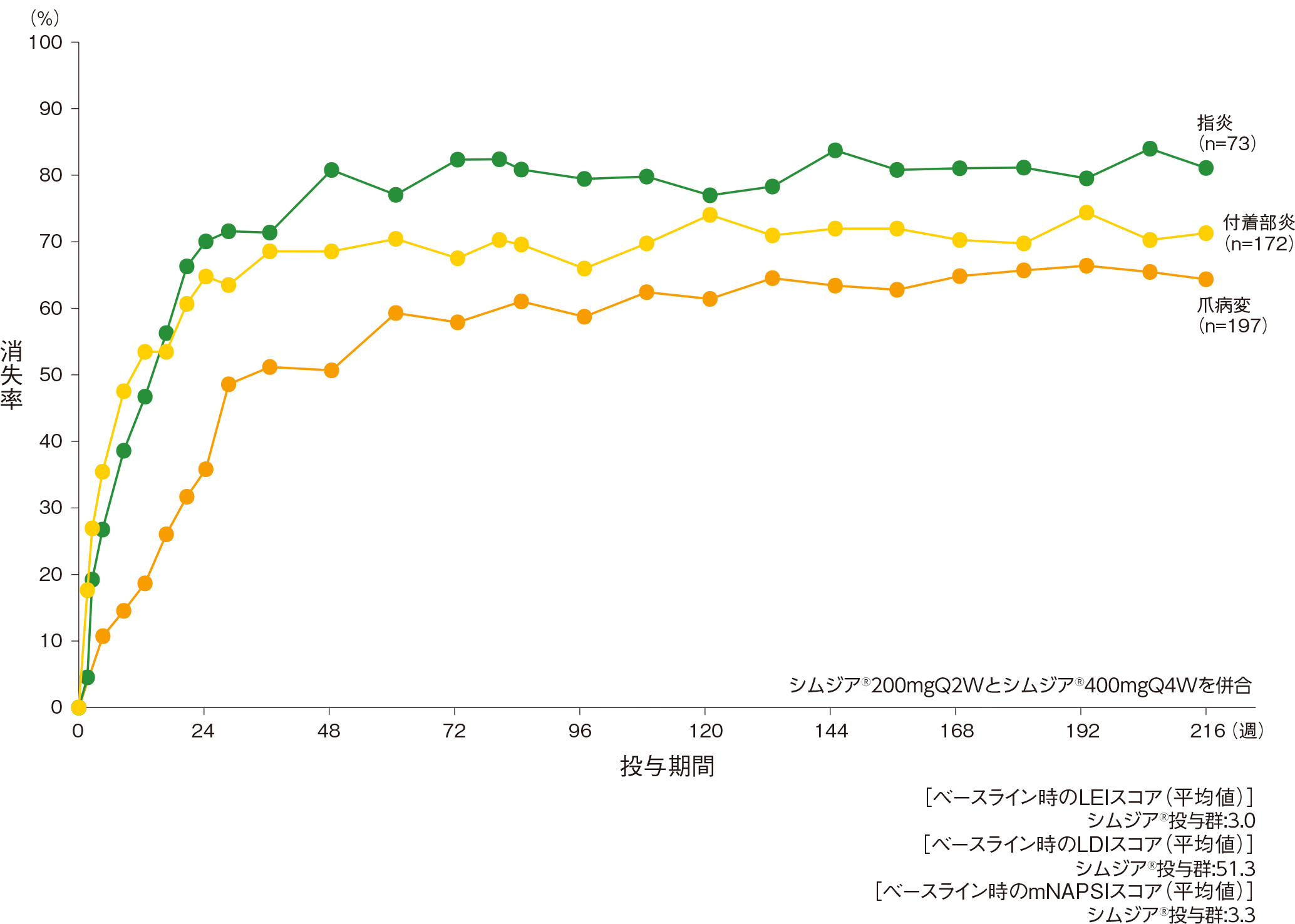
ベースラインのLEIスコアが0を超える患者、指炎と評価されかつ反対の指との周囲径の差が10%以上の指を1本以上有する患者、ベースラインのmNAPSI>0の患者を対象とした。
付着部炎は、両側の上腕骨外側上顆(肘)、大腿骨内側上顆(膝)及びアキレス腱(踵)を触診することで評価され、0(痛みなし)又は1(痛みあり)でスコア化された。
指炎の有無の判定は、LDI basic(反対の指との周囲径の差が10%以上で評価)と治験責任医師による指炎の評価によって行われた。
mNAPSIはベースライン来院時に最も病変の重い爪を選択し、その後の来院でも同じ爪を評価した。選択した爪について、爪甲剥離/油滴状変色、爪甲の崩壊及び点状陥凹をそれぞれ0~3でスコア化し、また、爪甲白濁、線状出血、爪床角質増殖及び爪半月の紅色斑点をそれぞれ0又は1でスコア化した。
LEI:Leeds Enthesitis Index、LDI:Leeds Dactylitis Index、mNAPSI:修正爪乾癬重症度指数、LOCF:last observation carried forward
安全性
24週までの期間に発現した副作用は、シムジア®投与群全体で332例中86例(25.9%)、プラセボ群で136例中37例(27.2%)に認められました。主な副作用はシムジア®投与群全体で上気道感染及びALT増加各7例(2.1%)等、プラセボ群で上気道感染3例(2.2%)、ALT増加2例(1.5%)等でした。
重篤な有害事象は、シムジア®投与群全体で22例、プラセボ群で6例、投与中止に至った有害事象は、シムジア®投与群全体で10例、プラセボ群で2例でした。
死亡に至った有害事象は、シムジア®投与群全体で2例(心停止及び突然死)に認められましたが、本剤との因果関係は「関連なし」と判断されました。
216週までの期間に発現した副作用は、シムジア®投与群全体で393例中199例(50.6%)に認められました。
主な副作用はシムジア®投与群全体で上気道感染31例(7.9%)、鼻咽頭炎29例(7.4%)、咽頭炎25例(6.4%)及び気管支炎23例(5.9%)等でした。
重篤な有害事象は、シムジア®投与群全体で100例に認められ、乾癬性関節症8例、変形性関節症、肺炎及び皮膚潰瘍各4例等でした。
投与中止に至った有害事象は、シムジア®投与群全体で54例に認められ、潜伏結核6例、ツベルクリン反応陽性4例、ALT増加、AST増加及び乾癬性関節症が各3例等でした。
死亡に至った有害事象は24週までの2例以外に、4例(乳癌、肺炎及び敗血症、心筋梗塞、リンパ腫)に認められ、本剤との因果関係は、乳癌及び心筋梗塞で「おそらく関連なし」、リンパ腫で「関連あるかもしれない」、肺炎及び敗血症で「関連あり」と判断されました。
試験概要
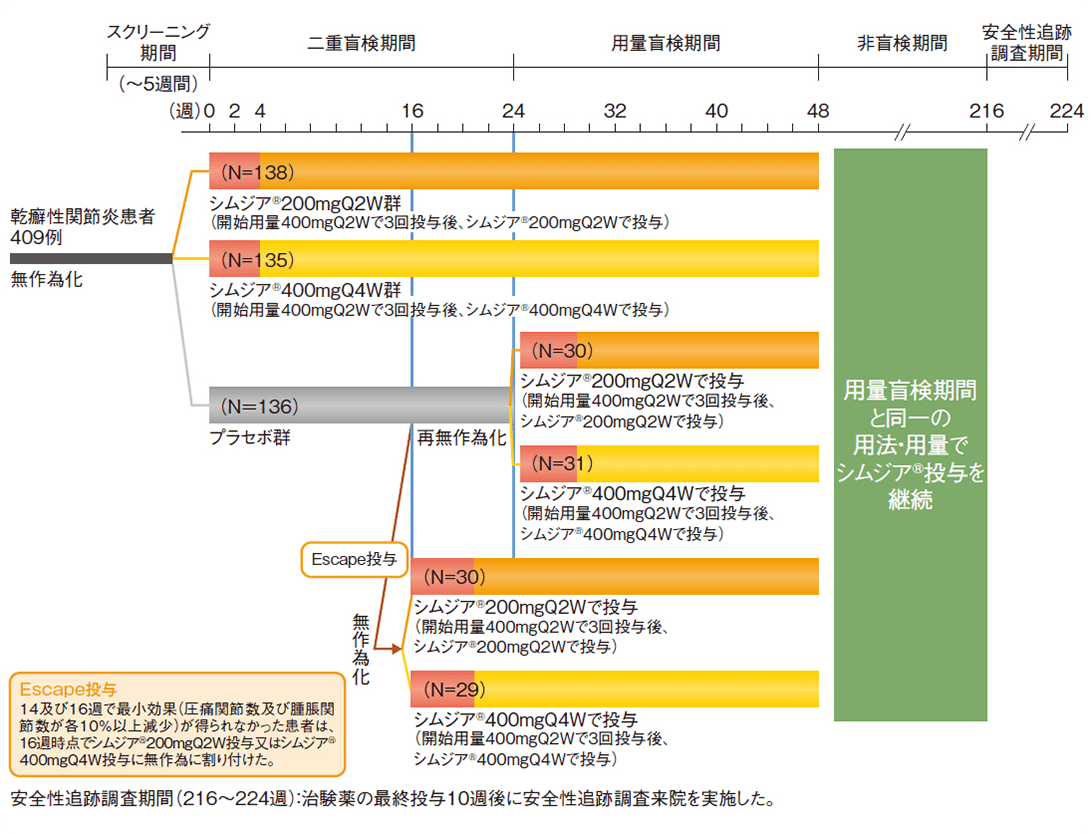
Q2W:2週間隔、Q4W:4週間隔
- 対象
-
18歳以上の乾癬性関節炎患者 409例
・乾癬性関節炎の分類基準(CASPAR)に基づき、成人発症の乾癬性関節炎と診断され、6ヵ月以上経過した患者
・活動性乾癬性皮膚病変を有する患者、又は乾癬の既往を有する患者
・スクリーニング及びベースラインの圧痛関節数≧3かつ腫脹関節数≧3で、スクリーニング期間に赤血球沈降速度≧28mm/h又はCRP>基準値上限のすべてを満たす活動性関節炎を有する患者
・1種類以上のDMARDが無効な患者
- 試験デザイン
-
多施設共同、二重盲検、無作為化、プラセボ対照、並行群間比較
- 投与方法
-
シムジア®200mgQ2W群、シムジア®400mgQ4W群又はプラセボ群のいずれかに1:1:1の割合で無作為に割り付けた。シムジア®200mgQ2Wは開始用量400mgを2週間隔で3回投与し、その2週後より200mgを2週間隔で継続投与、400mgQ4Wは開始用量400mgを2週間隔で3回投与し、その4週後より400mgを4週間隔で継続投与した。
なお、プラセボ群は、16週時又は24週時にシムジア®200mgQ2W投与又はシムジア®400mgQ4W投与に1:1の割合で無作為に割り付けた。
- 評価項目
-
主要評価項目:12週時のACR20反応率、24週時のmTSSのベースラインからの変化量
副次評価項目:48週時のmTSSのベースラインからの変化量 等
その他の評価項目:付着部炎(LEIスコア)、指炎(LDIスコア)、爪病変(mNAPSIスコア)の改善 等
- 解析計画
-
12週時のACR20反応率では、シムジア®群とプラセボ群との比較はWald漸近検定(有意水準両側5%)を用い、差の95%信頼区間は漸近標準誤差(漸近Wald信頼限界)を用いて算出した。Wald漸近検定及び信頼区間の算出には、連続修正を用いなかった。また、24週時のmTSSのベースラインからの変化量では、シムジア®群とプラセボ群との比較は投与群、地域及び過去のTNF阻害薬の使用の有無を因子とし、ベースラインのmTSSを共変量としたANCOVAを用いた。
承認時評価資料 : 海外第Ⅲ相二重盲検比較試験成績 RAPID-PsA試験
van der Heijde D. et al.: RMD Open. 4: e000582, 2018
本論文の研究資金はUCB Pharmaから提供を受けたものである。
- 6. 用法及び用量(抜粋)
- 〈尋常性乾癬、乾癬性関節炎、膿疱性乾癬、乾癬性紅皮症〉
通常、成人にはセルトリズマブ ペゴル(遺伝子組換え)として、1回400mgを2週間の間隔で皮下注射する。症状安定後には、1回200mgを2週間の間隔、又は1回400mgを4週間の間隔で皮下注射できる。



